ТЕМА УРОКУ: "Речовини, їх фізичні властивості. Чисті речовини й суміші"
МЕТА УРОКУ: Повторити відомості про речовини, суміші та їхні властивості; навчити учнів розрізняти фізичні тіла, матеріали, речовини; повторити поняття «чисті речовини» та «суміші», основні способи розділення сумішей; продовжити ознайомлення з лабораторним устаткуванням і методикою проведення хімічного експерименту.
ХІД УРОКУ
I.Організація класу.
Перевірка присутності і готовності учнів до уроку. Здача письмових робіт.
II.Мотивація уроку.
На сьогоднішньому уроці ми вивчаємо дуже важливу тему, від того як ви сприймете її буде залежати подальше вивчення хімії.
III.Повідомлення теми, мети уроку.
Тема коротко записується на дошці, мета повідомляється усно.
IV.Актуалізація знань.
Проводиться опитування у формі бесіди:
1. Як ми називаємо ті предмети, що нас оточують?
2. Дайте визначення тілам...
3. На які групи можна поділити тіла?
4. Які можна назвати тіла живої і неживої природи?
5. Чи всі тіла людина бере з природи?
6. Назвіть тіла, які людина виготовляє сама...
7. Які властивості мають тіла? (Форму, об'єм, масу.)
8. Які властивості мають речовини? (Колір, смак, запах, густину, твердість та ін.)
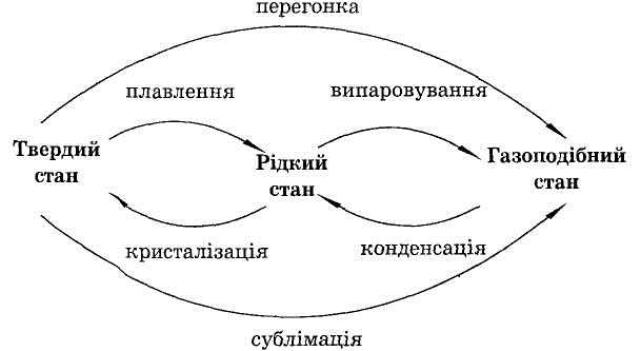
9. у яких агрегатних станах можуть перебувати речовини? Охарактеризуйте кожен зі станів.
У ході бесіди встановлюється зв'язок між поняттями «речовина» й «матерія». Все те, чим людина оточена, діє на її органи почуттів (прямо чи
опосередковано, через прилади), викликаючи відчуття (кольору, розміру, форми, світла, удару електричного струму і т. д.), називається матерією. Речовина - один із видів матерії. З речовин складаються фізичні тіла.
При актуалізації знань стосовно агрегатних станів речовини всі відомості можна узагальнити у вигляді такої схеми:
V.Вивчення нового матеріалу.
1. ПОНЯТТЯ ПРО РЕЧОВИНУ, МАТЕРІЮ, ТІЛА.
Відзначивши різноманіття відомих і знову одержуваних речовин, роз'яснюються їх відмінності за властивостями. Сукупність властивостей відрізняє одну речовину від інших. Деякі властивості можуть бути подібними у різних речовин. Опис властивостей речовин є одним із завдань хімії.
Завдання.
Розподіліть по стовпчиках таблиці назви тіл і речовин: хімічний посуд, стілець, авторучка, цвях, ложка, деревина, залізо, скло, алюміній, пластмаса.
Тіла і речовини
|
Тіло |
Речовина |
|
|
|
Демонструються учням різні предмети зі скла: що спільного між цими предметами?
Формулюється поняття речовини (те, з чого складається фізичне тіло).
Учням пропонується назвати вироби з деревини, гуми, пластмаси, заліза, міді, алюмінію.
Встановлюється різниця між речовиною і матеріалом (правило в підручнику).
2. ВЛАСТИВОСТІ ТІЛ І РЕЧОВИН.
Увага учнів звертається на відмінності властивостей тіл і речовин. Слід зазначити, що властивості тіл і речовин вивчаються різними шкільними предметами. Тіла неживої природи, їхні розміри, об’єм, властивості, існування в природі вивчають на уроках геометрії, фізики, географії а тіла живої природи (рослини й тварини) - на уроках біології. На уроках хімії розглядають властивості речовин, з яких утворені тіла як неживої, так і живої природи. Наприклад, властивість кам'яного вугілля горіти вивчають на уроках хімії; його твердість, густину, здатність проводити електричний струм - на уроках фізики; походження вугілля розглядається на уроках біології, а поширення цього мінералу - на уроках географії.
Пізнаючи властивості речовин, людина тим самим пізнає їхній внутрішній світ: склад, будова, властивості притаманні всім речовинам, вони об'єктивні. Це підтверджується тим, що речовина за тих самих умов виявляє постійні властивості незалежно від того, чи людина створює ці умови, чи вони снують у природі. Так, за земних умов кухонна сіль завжди буде розчинятися, стикаючись із водою, і а бензин - горіти, коли його запалюють на повітрі.
Вказуючи на скляні предмети, ставиться запитання:
Ø чим відрізняються ці предмети? (формою).
Демонструючи пластинки різних металів однакової форми, ставиться запитання про відмінність цих предметів (за кольором). Наливши у пробірки різні речовини прозорого кольору, учням пропонується понюхати і встановити різницю (за запахом). Встановлюються спільне і відмінне між: дощовою водою, льодом і водяною парою (агрегатний стан). До всіх ознак, за якими різняться речовини додається ще смак, блиск, температуру плавлення, кипіння, тепло- і електропровідність.
Формулюється поняття властивостей речовин (правило в підручнику).
Завдання.
Опишіть властивості добре відомих вам речовин: а) міді й алюмінію; б) солі й цукру. Порівняйте ці речовини.
План дій при порівнянні речовин:
Ø виділення основних ознак порівняння;
Ø визначення властивостей речовин, які зіставляються;
Ø виявлення подібності й відмінності у властивостях конкретних речовин;
Ø висновки.
3.ЛАБОРАТОРНА РОБОТА №1 «РОЗГЛЯДАННЯ РЕЧОВИН ІЗ РІЗНИМИ ФІЗИЧНИМИ ВЛАСТИВОСТЯМИ».
Учитель нагадує учням правила поведінки під час лабораторних та практичних робіт і правила техніки безпеки, потім роздає варіанти завдань.
I варіант. Кухонна сіль і алюміній.
II варіант. Вода й залізо.
ІІІ варіант. Оцтова кислота й рослинна олія.
IV варіант. Мідь і сода.
Учні проводять лабораторні дослідження, свої спостереження учні записують у формі порівняльної таблиці за планом: агрегатний стан; колір, блиск; запах; розчинність у воді; відносна густина – визначається відносно води й роблять висновки.
4. ПОНЯТТЯ ПРО МОЛЕКУЛИ, ЧИСТІ РЕЧОВИНИ Й СУМІШІ.
Поняття про молекули відоме із курсу фізики. Дається повне з хімічної точки зору визначення молекули (від ; тоles - частинка): це дрібні частинки речовини, що зберігають усі її властивості. Молекули є безпосередніми носіями лише хімічних властивостей речовини. А фізичні властивості (колір, густина, температура плавлення, кипіння, розчинність та ін.) притаманні сукупності молекул, тобто речовині в цілому.
Кожна речовина має свою, характерну лише для неї молекулу. Коли мова йде про чисті речовини, то мається на увазі, що вони складаються з однакових молекул. Чисті речовини - це речовини, що складаються тільки з однакових частинок (атомів, молекул, іонів), Абсолютно чистих речовин не буває й добути їх важко. Речовина вважається чистою, якщо вона містить не більше однієї молекули домішок на 1000 -10 000 молекул основної речовини. На практиці ми задовольняємося речовинами з різним ступенем чистоти (99%), називаючи їх чистими.



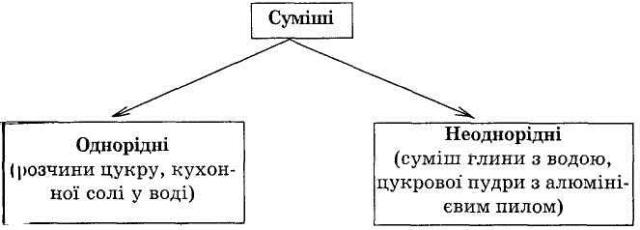
Найчастіше ми маємо справу із сумішами. Суміші - це сукупність молекул або чистих індивідуальних речовин. Суміші складаються з різних частинок (атомів, молекул, іонів) і різних речовин (двох, трьох і більше).
5. КЛАСИФІКАЦІЯ СУМІШЕЙ.
Суміші можна поділити на дві групи: однорідні й неоднорідні. Разом з учителем встановлюється різниця між поняттями неоднорідної і однорідної суміші та формулюються правила (для прикладу демонструється кухонна сіль з піском та з водою).
Однорідними називаються суміші, в яких навіть за допомогою мікроскопа можна виявити частинок речовин, що входять до їх складу, неоднорідними називаються суміші, в яких неозброєним оком або за допомогою мікроскопа можна помітити частинки речовин, що входять до їх складу. Однорідні суміші найчастіше називаються розчинами, неоднорідні суміші - зависями, суспензіями або емульсіями.
Робота з таблицею.
Учні заповнюють таблицю, записуючи до відповідних стовпчиків приклади чистих речовин і сумішей.
|
Чисті речовини |
Однорідні суміші |
Неоднорідні суміші |
|
|
|
|
6. ВЛАСТИВОСТІ ЧИСТИХ РЕЧОВИН ТА ІХНІХ СУМІШЕИ.
У житті ми зустрічаємося із сумішами, що складаються з двох і більше чистих речовин – це повітря, молоко, туман, розчин солі чи цукру в воді. З’ясуємо, чи зберігають чисті речовини свої властивості, знаходячись в суміші?
Робити висновок про властивості речовини можна лише тоді, коли вона чиста. Наприклад, відомо, що, вивчаючи властивості морської води, не можна зробити висновку про властивості чистої води.
Чиста вода з тиском 101,3 кПа має температуру плавлення 0° С температуру кипіння +100 °С. Якщо розчинити у воді цукор або кухонну сіль, то температури плавлення й кипіння цих розчинів будуть відрізнятися від температур плавлення й кипіння чистої води. Крім того, з'явиться нова властивість - смак. Чиста вода не має смаку, а розчин цукру є солодким. Чим більше цукру в розчині, тим сильніше відрізняються його властивості від властивостей чистої води. Суміші відрізняються за властивостями від тих речовин, з яки вони складаються. Наприклад, азот має густину 1,25 кг/м3, кисень - 1,43 кг/м3, а повітря - суміш, яка складається в основному з цих газів - має густину 1,29 кг/м3.
Демонстрація.
1) Показується при змішуванні, що речовини не змінюють властивостей.
Учні розглядають порошки сірки й заліза, звертаючи увагу її їх колір і магнітні властивості. Після змішування порошків сірка залишається жовтою, а залізо - сірим і таким, що при тягається магнітом. (Магніт краще підносити до залізного порошку через шар паперу, щоб потім було легше відокремити від нього залізний порошок.)
2)Учитель демонструє утворення хімічної сполуки. Суміш порошків заліза й сірки обережно нагрівається в полум'ї спиртівки. Одержана сполука і за кольором, і за магнітними властивостями відрізняється від сірки й заліза. Учні роблять висновок, що хімічна сполука (нова речовина) відрізняється за властивостями від вихідних речовин.
Демонструються чисті речовини сірка і залізо, разом з учнями з’ясовують їх властивості (змочування водою, дія магнітом), змішуються речовини і робляться спостереження за їх властивостями (учні самостійно роблять висновок про те, чи зберігаються властивості речовин в суміші і формулюють поняття суміші).
У сумішах чисті речовини виявляють свої індивідуальні властивості, звідки випливає головна й основна відмінність сумішей від чистих речовин: суміші можна розділити на індивідуальні речовини за допомогою фізичних методів.
7. ОСНОВНІ МЕТОДИ РОЗДІЛЕННЯ СУМІШЕЙ.
Для вивчення властивостей речовин їх необхідно звільнити від домішок, тобто очистити. Способи очищення залежать від властивостей речовин, які розділяються. Існує багато способів розділення сумішей. Серед них можна виділити декілька основних.
Відбувається знайомство зі способами розділення сумішей ( відстоювання, фільтрування, випарювання, кристалізація та дистиляція) з допомогою таблиці, підручника і демонстрацій учителя (залізні ошурки і тирса, олія і вода – відстоювання, пісок і вода - фільтрування, сірка і залізні ошурки – дія магнітом, кухонна сіль і вода – випарювання або кристалізація).
Робота з таблицею.
|
Методи розділення сумішей
|
Короткий опис розділення сумішей
|
Які суміші можна розділяти |
|
1.Розділення магнітом |
Базується на здатності деяких речовин притягатися магнітом |
Суміші твердих речовин, одна з яких притягається магнітом |
|
2. Відстоювання |
Суміш, що складається з твердих речовин, висипається у воду (або іншу рідину з придатною густиною). Суміш, яка складається з рідких речовин, залишається на деякий час до розшарування |
Неоднорідні суміші двох твердих або двох рідких речовин з різною густиною |
|
3. Фільтрування |
Суміш пропускається через тіло сито або фільтр), у якому є пори отвори відповідного розміру |
Неоднорідні суміші рідких і твердих, твердих і газоподібних, рідких і газоподібних речовин |
|
4. Випарювання |
Суміш піддається нагріванню, під час якого рідина випаровується, а тверда речовина залишається у вигляді кристалів |
Однорідні суміші рідких і твердих речовин |
|
5. Кристалізація |
Суміш твердої і рідкої речовин нагрівається. Після випаровування частини рідини суміші охолоджуються. Тверда речовина випадає в осад у вигляді кристалів |
Однорідні суміші розчинних твердих і рідких речовин |
|
6. Дистиляція (перегонка) |
Суміш двох рідин повільно нагрівається. За цих умов речовина, яка найлегше закипає, випаровується раніше, її пари охолоджуються, конденсат збирається в окремій ємності |
Однорідні суміші двох рідин із різними температурами кипіння |
VI.Закріплення знань учнів.
1. Випишіть, які з наведених ознак: круглий, безбарвний, розчинний, плоский, овальний, прозорий, зелений, нерозчинний, кристалічний, електропровідний, крихкий, газоподібний, скляний, опуклий, важкий, твердий, легкий, рідкий, такий, що має певну температуру плавлення, - можуть бути віднесені: а) тільки до речовин б) тільки до тіл в) і до тіл, і до речовин.
2. Випишіть окремо назви тіл, матеріалів і речовин із даних переліків: а) пробірка, скло, крейда, вода, залізо, алюмінієвий дріт, цвях, торф, кисень, керамічний посуд, нафта, гас, шматок крейди: б) олівець, підкова, графіт, вода, цукор, лійка, лінійка, алюміній, стіл, крохмаль, бензин, склянка, залізо.
3Вкажіть тіла, що складаються з однієї і тієї самої речовини: а) краплина води, кисень, сніжинка, залізний цвях, крижинка: б) свинцева пластинка, мідна спіраль, колба, алюмінієвий дріт, свинцева куля, мідний казан.
4. З даного переліку понять випишіть ті, якими можна охарактеризувати речовину: колір, запах, розмір, маса, форма, зріст, хімічні властивості, температура, агрегатний стан, об'єм розчинність, смак, фізичні властивості, температура плавлення.
5.Порівняйте фізичні властивості цукру й оцту. Вкажіть ознаки подібності і відмінності.
Завдання.
Учням пропонуються завдання різних рівнів складності. Це сприяє розвитку їхнього мислення та вказує на рівень засвоєння знань.
Рівень 1. Порівняйте фізичні властивості:
а) ртуті й алюмінію, б) міді й цинку, в) крейди й вугілля.
Рівень 2. Яких двох найхарактерніших ознак достатньо, щоб протиставити дві речовини (див. перше запитання)?
Рівень 3. З якими властивостями пов'язане найвідоміше застосування таких речовин:
а) скла, б) міді, в) заліза? Які властивості вважаються їхнім недоліком?
Колективне обговорення.
Розглядаються способи очищення кухонної солі від не розчинних у воді часточок (піску, тирси чи ошурок).
Ø Які фізичні властивості має кухонна сіль?
Ø Як розділити суміш солі з речовиною, не розчинною у воді?
Складається план дії яким учні зможуть скористатися наступного уроку під час виконання практичної роботи: 1) розчинити суміш у воді; 2) відокремити домішку нерозчинної речовини методом фільтрування; 3) випарити очищений розчин солі.
Завдання
1. У цукор випадково потрапив розкришений корок. Як очистити від нього цукор?
2. Запропонуйте способи розділення сумішей: а) вода й бензин; б) кухонна сіль і крейда; в) кухонна сіль, ошурки й тирси; г) незбиране молоко.
VII.Підсумок уроку.
Аналіз роботи класу під час уроку, виставлення оцінок за відповіді.
VIII.Завдання додому.
Вивчити: § 4 - 5, с. 33 виконати завдання 20,26, с. 40 виконати завдання 30, 35.
Додаток до лабораторної роботи №1
„Розгляд речовин з різними фізичними властивостями”
|
Назва речовини |
Агрегатний стан |
Колір, блиск |
Запах |
Розчинність у воді |
Відносна густина |
|
Кухонна сіль |
тверда речовина |
Прозорий, білий |
немає |
розчиняється |
важчий за воду |
|
Алюміній |
тверда речовина |
світло-сірий, блискучий |
немає |
не розчиняється |
важчий за воду |
|
Вода
|
рідина |
прозорий |
немає |
---- |
---- |
|
Залізо |
тверда речовина |
темно-сірий, блискучий |
ледь відчутний |
не розчиняється |
важчий за воду |
|
Оцет
|
рідина |
прозорий |
різкий |
розчиняється |
---- |
|
Олія |
рідина |
жовтий |
специфічний |
не розчиняється |
легший за воду |
|
Мідь |
тверда речовина |
червоний, блискучий |
ледь відчутний |
не розчиняється |
важчий за воду |
|
Сода |
тверда речовина |
білий |
немає |
розчиняється |
важчий за воду |