ТЕМА УРОКУ: "Поняття про амфотерні основи"
МЕТА УРОКУ: Розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ; розширити Знання учнів про властивості основ і кислот на прикладі амфотерних сполук; формувати вміння й навички складання рівнянь хімічних реакцій на прикладі амфотерних основ.
ХІД УРОКУ
І Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ Мотивація уроку.
З курсу біології вам відомий такий термін, як земноводні, або амфібії – це тварини, які здатні існувати і в воді і на поверхні землі. В хімії теж є сполуки, які можуть проявляти подвійні властивості. Сьогоднішній урок буде присвячений вивченню цих сполук.
ІІІ Повідомлення теми, мети уроку.
Тема коротко записується на дошці, мета повідомляється усно.
IV Актуалізація знань.
Бесіда.
1. Яка хімічна властивість є найхарактернішою для кислот? Доведіть за допомогою рівняння хімічної реакції. (Взаємодія з основами.)
2. Яка хімічна властивість є найхарактернішою для основ? Доведіть за допомогою рівняння хімічної реакції. (Взаємодія з кислотами.)
Завдання:
1. Як, маючи мідь, хлоридну кислоту, натрій гідроксид, кисень, добути купрум (ІІ) гідроксид? Написати рівняння хімічних реакцій, зазначити їх тип.
V Вивчення нового матеріалу.
Лабораторна робота.
У пробірки наливається (0,5-1 мл) лугу, потім розчин солі цинку до випадання білого драглистого осаду - цинк гідроксиду. Учні записують рівняння реакції:
2NаОН + ZnС12 → Zn(ОН)2 + 2NaС1 .
Осад розділяється на дві пробірки, у першу поміщається розчин хлоридної кислоти. Осад розчиняється:
Zn (ОН)2 + 2НС1 → ZnС12 + 2Н2О (рівняння 1).
Ставиться проблемне питання: чи буде Zn(ОН)2 реагувати з NаОН? Звичайно ні, оскільки основи з основами не реагують. Пропонується розв'язати питання експериментально. До другої частини осаду Zn(ОН)2 додається надлишок розчину NаОН. Осад розчиняється. Отже, відбулася хімічна взаємодія речовин:
Zn(ОН)2 + 2NаОН → Nа2ZnO2 + 2Н2О (рівняння 2).
Робиться висновок про те, що цинк гідроксид взаємодіє і з кислотами, і з основами. Такі гідроксиди (й оксиди) називаються амфотерними, вони мають властивості кислот і основ. Префікс «амфо-» свідчить про подвійність властивостей. Для кращого розуміння рівняння 2 записується формула цинк гідроксиду в такий спосіб:Н2ZnO2, тоді
Н2ZnO2 + 2NaOН → Nа2ZnO2 + 2Н2О .
Очевидно, що це реакція обміну, яка веде до утворення солі й води.
Повідомляється, що й цинк оксид має аналогічні властивості. Учні записують рівняння реакцій, що характеризують цинк оксид як амфотерний, тобто рівняння взаємодії ZnО з кислотою й основою:
ZnО + 2НС1 = ZnСl2 + Н2O (рівняння 3);
ZnО + 2КOН = К2ZnO2 + Н2O (рівняння 4).
Реакція 4 проходить під час сплавляння реагуючих речовин. Як приклад елемента, що утворює амфотерні сполуки, наводиться Алюміній, його оксид і гідроксид. Доказом амфотерності оксиду буде взаємодія з кислотою та основою:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Розчинення амфотерних гідроксидів у розчинах лугів розглядається як процес утворення гідроксокомплексів:
Амфотерні оксиди взаємодіють з кислотами: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Під час сплавляння амфотерних оксидів із натрій гідроксидом: Al2O3 + 2NaOH → 2NaAlO2 + H2O
Під час взаємодії амфотерних оксидів із розчином натрій гідроксиду:
Амфотерні властивості мають і самі метали:
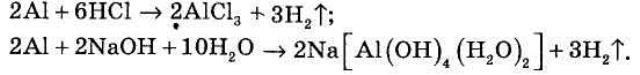
VI Закріплення знань учнів.
Сценка – „Амфотерні елементи”.(Записати відповідні рівняння хімічних реакцій)
ДІЙОВІ ОСОБИ: Алюміній, Цинк; офіціант.
(На дошці – плакат "Кафе". Стіл, стільці. Приходять елементи, сідають. Підходить офіціант.)
АЛЮМІНІЙ. Я як справжній метал хочу посмакувати вашою фірмовою сульфатною кислотою. Спочатку її охолодіть, потім підігрійте, налийте в келихи, перелийте у пляшку і подайте до столу, ЦИНК. Приєднуюся. (Офіціант іде.)
АЛЮМІНІЙ. Сьогодні дуже гарна тепла погода.
ЦИНК. Так дощик капає з ранку, і вітер дме з півночі.
АЛЮМІНІЙ. Вже видно, що майже зима – сонце за хмарами, рослини пожовкли. З птахів лише горобці та ворони залишилися.
ЦИНК. Сонечко пригріває, соловейко витьохкує.
(Приходить офіціант, приносить замовлення. Алюміній та Цинк випивають напій.)
ЦИНК. Що це? Кислота? Ти що голубе чайових не хочеш? Швиденько біжи і принеси лугу. Свіжого! Та не забудь: спочатку нагрій, потім дай охолонути, налий у пляшку, розлий по келихах.
АЛЮМІНІЙ. Приєднуюся. (Офіціант іде, знизуючи плечима)
АЛЮМІНІЙ. Отак завжди: кажеш біле, а всі – чорне. Погоджуєшся з усіма Не подобаєшся.
ЦИНК. Так. Хочеш як краще – і вашим і нашим, щоб нікому не було образливо – називають „хімічними хамелеонами” А ми ж просто амфотерні за природою.
АЛЮМІНІЙ. Правду кажете, друже Цинку. Проти природи не підеш!
(Входить офіціант з новим замовленням, витираючи лоба Ставить замовлення на стіл Елементи випивають.)
АЛЮМІНІЙ. Луг! Де книга скарг та пропозицій! Хто тобі сказав, що ми неметали? Хіба ж не видно, що ми справжнісінькі метали!
ОФІЦІАНТ. (обурено). То вам кислоти, то лугу, то ви метали!, то ви неметали, то вам нагрійте, то вам охолодіть, то налийте в пляшку, то розлийте по келихах! Розберіться самі із собою, хто ви є, і виконуйте свої замовлення самі (іде).
АЛЮМІНІЙ і ЦИНК (співають). А нам все одно – Метали чи ні, Амфотерні ми, Тобто Ці і Ті.
Завдання.
1). Два учні проводили хімічний експеримент з одержання амфотерного гідроксиду. Один із них спочатку влив у пробірку розчин лугу, а потім розчин солі амфотерного металу; а інший - розчин солі амфотерного металу, а потім розчин лугу. Чи має
значення порядок змішування розчинів? Чому?
2). Доведіть амфотерність берилій оксиду і берилій гідроксиду, написавши відповідні рівняння реакцій.
3). Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
Zn → ZnО → ZnС12→ Zn(ОH)2 → ZnSО4 → Zn(ОН)2 →Nа2ZnO2.
VII Завдання додому.
Вивчити: § підручника. Виконати завдання.
Розрахуйте масу солі, що утворюється під час взаємодії 14 г цинк гідроксиду з:
а) сульфатною кислотою; б) калій гідроксидом.
VIIІ Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.