ТЕМА УРОКУ: "Обчислення масової частки й маси розчиненої речовини в розчині"
МЕТА УРОКУ: Закріпити знання про масову частку розчиненої речовини; формувати вміння й навички обчислювати масову частку розчиненої речовини, застосовувати ці знання для обчислення маси розчиненої речовини, приготування розчинів із заданою масовою часткою розчиненої речовини
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
Працюючи з розчинами, важливо знати, скільки розчиненої речовини міститься в них, знати кількісний склад розчинів, бо в медицині, наприклад, в залежності від кількості речовини розчини можуть бути шкідливими або корисними. Сьогодні на уроці ми розглянемо різні типи задач на розчини.
ІІІ. Повідомлення теми, мети уроку.
На всіх етапах уроку учні працюють у складі груп. Результати роботи записуються консультантами в листку успішності
IV. Актуалізація знань.
Актуалізація знань учнів проводиться як повторення понять «розчин», «насичений розчин», «ненасичений розчин», «розбавлений розчин», «концентрований розчин».
Бесіда.
1. Дати визначення розчину.
2. Як визначається маса розчину?
3. Що показує масова частка розчиненої речовини, виражена у відсотках?
4. Яка величина характеризує розчинність речовини у воді?
Реставрація формул
Учні встановлюють взаємозв'язок між величинами.
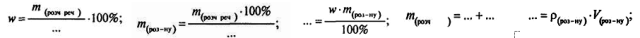
Усне розв'язування задач
1. Визначте масу розчину, який утворюється при розчиненні 40 г NaOH у 500 мл води. (540 г)
2. У 200 г розчину цукру міститься20 г цукру. Визначте масову частку цукру в розчині. (10%)
3. 5 г кухонної солі розчинили у 95 мл води. Визначте масову частку кухонної солі в розчині. (5%)
4. Коефіцієнт розчинності солі становить 50 г. Скільки грамів розчиненої речовини міститься в 300 г
розчину солі? (100 г)
5. До 200 г 40%-вого розчину калій хлориду долили 200 г води. Визначте масову частку солі в утвореному розчині. (20%)
Таблиця
Групи учнів по черзі розв'язують задачі, умови яких наведено в таблиці, та записують відповіді у відповідних комірках.
|
№ |
т розчиненої речовини, г |
тН20, г |
т розчину, г |
ω,% |
|
1 |
50 |
|
450 |
|
|
2 |
80 |
|
|
20 |
|
3 |
|
300 |
400 |
|
|
4 |
|
600 |
|
40 |
V. Повторення і поглиблення матеріалу.
1. Розрахуйте об'єм концентрованої хлоридної кислоти (густина 1,19 г/мл), що містить 38 % хлороводню, необхідний для приготування 1 л 5% -ї хлоридної кислоти (густина 1 г/мл).

2. У якому співвідношенні слід змішати 5% -й розчин їдкого калію з 40%-м розчином цієї ж речовини, щоб добути 250 г 25%-го розчину калій гідроксиду?
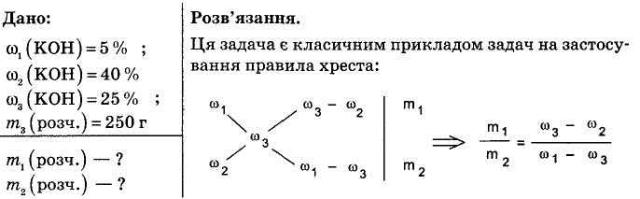

Аукціон способів розв'язку
2 бали за завдання отримує група учнів, яка представить кілька способів розв'язання задач.
До розчину масою 300 г з масовою часткою натрій нітрату 20% додали розчин масою 500 г з масовою часткою натрій нітрату 40%. Обчисліть масову частку солі в утвореному розчині.
Задачі-малюнки
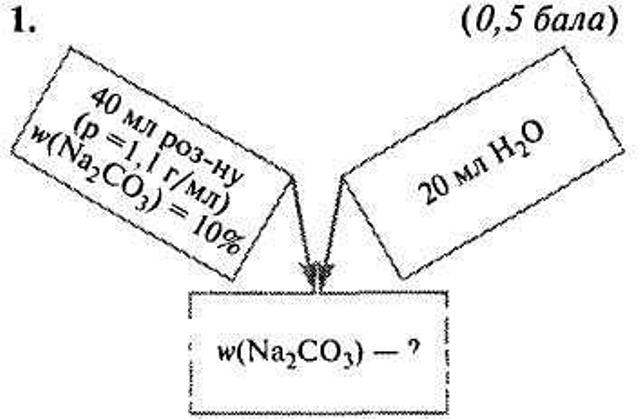
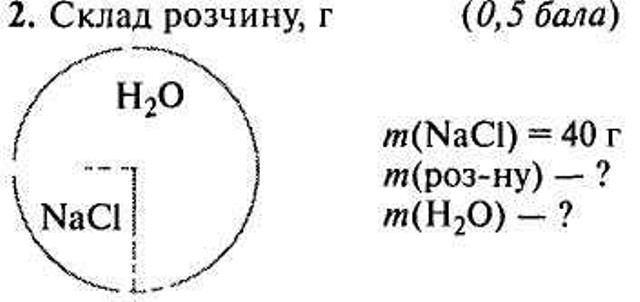

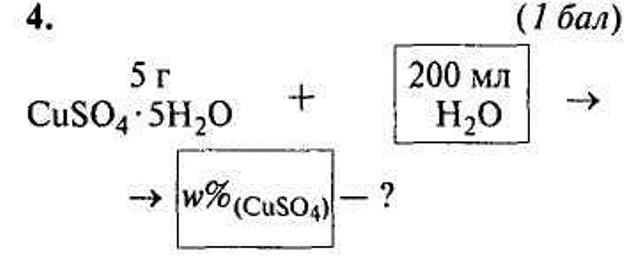
VI. Закріплення знань учнів.
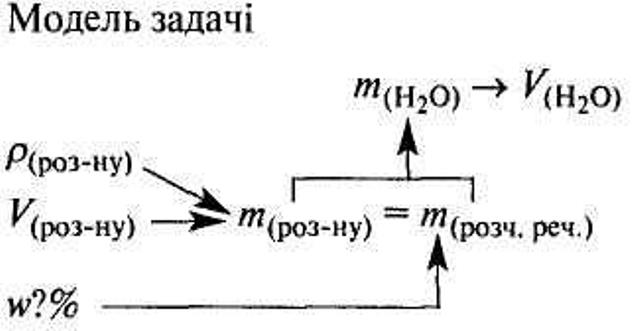
Творче завдання
Скласти умову задачі за її моделлю.
Виведення формули
Для характеристики складу розчину також використовується молярна концентрація, вона розраховується за формулою:
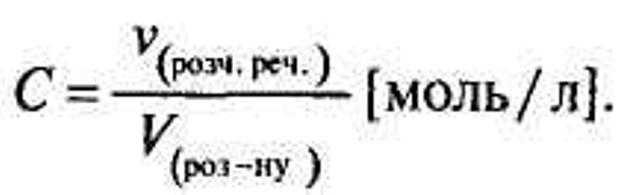
Учням пропонується вивести формулу переходу ω% → С (ρ в г/л) та С → ω %.
VIІ. Завдання додому.
Повторити § 1-6. Придумати три задачі на розчин.
VIIІ. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються
оцінки за урок.
Листок успішності групи №_________ Консультант__________
|
Склад групи |
АОЗ |
Реставрація формул |
Усний розв'язок |
Таблиця |
Аукціон |
Задачі-малюнки |
Творче завдання |
Виведення формули |
Оцінка |
|
Максимальна кількість балів |
0,5 |
0,5 |
0,5 |
0,5 |
2 |
3 |
1 |
2 |
12 |
ДОДАТКОВИЙ МАТЕРІАЛ ДО УРОКУ
1) Через 1 л розчину амоніаку з масовою часткою, що дорівнює 10 %(густина 0,96 г/мл), пропустили 10 л амоніаку (н. у.). Обчисліть масову частку амоніаку в розчині, що утворився.
2) До 360 г насиченого розчину натрій карбонату (розчинність 21,5гу 100 г води) додали 40 г розчину тієї ж речовини з масовою часткою 3 %. Визначте концентрацію розчиненої речовини в добутому розчині.
3) Через 250 г 5,75%-го розчину амоніаку пропустили 10,5 л амоніаку (н. у.). Обчисліть масову частку амоніаку в добутому розчині.
4) Визначте масову частку нітратної кислоти, добутої при змішуванні 40 мл 96% -го розчину HNO3 (густина 1,5 г/мл) і 30 мл 48% - го розчину HNO3 (густина 1,3 г/мл).
5) Визначте маси 55%-го і 15%-го розчинів сульфатної кислоти, необхідних для добування 500 г 30% -го розчину.
РОЗВ'ЯЗУВАННЯ ЗАДАЧ ІЗ ЗАСТОСУВАННЯМ ПОНЯТТЯ ПРО КРИСТАЛОГІДРАТИ.
1. Кристалогідрат купрум (II) сульфату масою 5 г розчинили в 5 мл води. Розрахуйте масову частку солі в добутому розчині.
2. Яку масу глауберової солі необхідно додати до 100 мл 8% -го розчину натрій сульфату (густина 1,07 г/мл), щоб подвоїти масову частку речовини в розчині?


3. 25 г мідного купоросу розчинили у 135 води. Визначте масову частку розчиненої речовини (M(CuSO4) = 160 г/моль, a M(CuSO4 · 5Н2О) = 250г/моль). (10%)
4. Яку масу мідного купоросу й води треба взяти для приготування 40 кг 20% -го розчину купрум сульфату?