ТЕМА УРОКУ: "Промисловий синтез аміаку: вибір оптимальних умов синтезу, будова і робота колони синтезу.
Охорона довкілля під час виробництва та використання аміаку"
МЕТА УРОКУ: Розширити уявлення учнів про загальні принципи хімічного виробництва; ознайомити з виробництвом аміаку, з хімічними реакціями, що лежать у його основі, й умовами їхнього протікання; поглибити знання про каталізатори й інші фактори, що впливають на швидкість хімічних реакцій; повторити матеріал про оборотні та необоротні реакції, хімічну рівновагу; розширити уявлення про вихід продукту реакції; пояснити принцип роботи апаратів: турбокомпресор, колона синтезу, холодильник, сепаратор.
ТИП УРОКУ: Комбінований.
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
На сьогоднішньому уроці ми будемо вивчати добування хімічної сполуки, що має дуже важливе народногосподарське значення і відіграє в життєдіяльності людини не останню роль.
ІІІ. Повідомлення теми, мети уроку.
IV. Актуалізація знань.
Хімічний диктант.
Напишіть формули (або назви) таких речовин: амоній сульфату, NH4Cl, NH3, амоній нітрату, амоній фосфату, (NH4)2SО4, амоній ортофосфату, амоній хлориду, (NH4)3РО4, амоній карбонату.
Самостійна робота в зошитах.
1) Укажіть, з якою речовиною буде реагувати амоній сульфат: хлоридною кислотою, натрій гідроксидом, кальцій оксидом, сульфатною кислотою, барій нітратом? Напишіть рівняння
реакцій.
2) Змішали 20 г гашеного вапна і 20 г амоній хлориду. Який об'єм аміаку (н. у.) можна одержати при нагріванні цієї суміші?
V. Вивчення нового матеріалу.
1. СИРОВИНА ДЛЯ СИНТЕЗУ АМІАКУ.
Урок проводиться з використанням гри, коли між учням розподіляються ролі директора виробництва, зацікавленого в підвищенні виробництва аміаку і інженера-технолога, який розповідає про етапи виробництва аміаку.
Одержання аміаку із солей амонію у промисловості не має сенсу. Сировиною для синтезу аміаку у промисловості є водень і азот. Азот одержують із рідкого повітря. Водень одержують із природного газу за реакцією: 2СН4 + О2 + 2Н2О = 2СО2 + 6Н2
2.. СИНТЕЗ АМІАКУ З АЗОТОВОДНЕВОІ СУМІШІ.
Рівняння реакції синтезу аміаку:
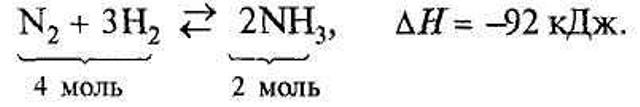
Основним завданням для виробництва аміаку є не просто добути аміак, а добути його найбільш економічним способом. Для цього необхідно з'ясувати оптимальні умови синтезу, тобто такі, за яких досягається найбільший вихід аміаку і процес здійснюється з великою швидкістю.
Фізико-хімічна характеристика реакції:
1) ця реакція є оборотною, отже, до кінця не доходить, у процесі реакції встановлюється хімічна рівновага;
2) реакція відбувається між газами зі зменшенням об'єму;
3) реакція екзотермічна, відбувається з виділенням теплоти.
Директора виробництва. Як необхідно змінити умови (концентрацію вихідних речовин, концентрацію аміаку, тиск, температуру) у системі для збільшення виходу аміаку? Як же керувати такою реакцією, пам'ятаючи, що виробництво аміаку має бути економічно вигідним?
За принципом Ле Шательє: якщо система перебуває у стані рівноваги, то в процесі дії на неї сил, що викликають зсув рівновага, система переходить у такий стан, в якому ефект цього впливу послаблюється. Якщо реакція екзотермічна, то треба знизити температуру, щоб аміак не розклався. Але зі зниженням температури швидкість реакції зменшиться. Це нібито не страшно, бо можна використати каталізатор. Проте відомо, що каталізатор виявляє свою активність лише із нагріванням до певної температури. Отже, знижувати температуру можна, але тільки до певної межі.
Реакція між газами відбувається зі зменшенням об'єму. Це означає, що рівновага зміщуватиметься у бік утворення аміаку за умови підвищеного тиску. Проте навіть за дуже високого тиску зв'язати весь азот і водень не вдається, а застосування високих тисків спричинює збільшення вартості обладнання і збільшення витрат енергії на стиснення газової суміші.
Виходячи з обговорення умов процесу, робимо висновок, що для синтезу аміаку треба:
а) застосувати невеликий тиск (З0 МПа), який дає змогу змістити рівновагу в бік утворення аміаку; б) використати каталізатор (губчасте залізо з домішками (А12О3 і К2О);
в) підвищити температуру (до 450 -550 °С).
Такі умови вважаються оптимальними для економічно доцільного синтезу аміаку.
Вихід аміаку в стані хімічної рівноваги його синтезу
|
Тиск |
Вихід аміаку (в %) при температурі (в °С) |
|||
|
(в МПа) |
400 |
450 |
500 |
550 |
|
10 З0 100 |
25,12 47,00 79,82 |
16,43 35,82 69,69 |
10,61 26,44 57,47 |
6,82 19,13 41,16 |
При дуже високому тиску молекули водню можуть дифундувати крізь обшивку колони синтезу. Тому розрізняють три способи виробництва: низького (10-15 мПа), середнього (25-З0 мПа) і високого (50-100 мПа) тиску. Температура реакції 500-550 °С, каталізатор - губчасте залізо з добавками калій оксидів й алюміній оксидів.
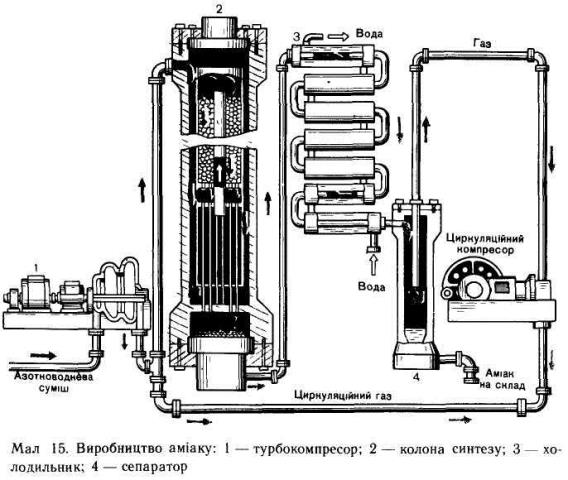 Інженер-технолог. Використовуючи схеми установки синтезу аміаку, пояснюється процес промислового синтезу аміаку, звертаючи увагу на інженерні принципи виробництва: протиток у теплообміннику, теплообмін між сумішшю, що надходить, циклічність виробництва, очищення реакційної суміші.
Інженер-технолог. Використовуючи схеми установки синтезу аміаку, пояснюється процес промислового синтезу аміаку, звертаючи увагу на інженерні принципи виробництва: протиток у теплообміннику, теплообмін між сумішшю, що надходить, циклічність виробництва, очищення реакційної суміші.
Суміш азоту і водню у співвідношенні 1 : 3 ретельно очищається від домішок (яка призводять до отруєння каталізатора) і під певним тиском подається в колону синтезу. У колоні суміш проходить через шар каталізатору і при цьому іде утворення аміаку. Із колони суміш азоту, водню і аміаку направляється у теплообмінник, де. відбувається скраплення аміаку. Скраплений аміак відділяється від азото-водневої суміші, що не прореагувала. Ця суміш повертається до колони синтезу.
Реакція відбувається в колоні синтезу. Колона синтезу складається з теплообмінника (нижня частина) і каталізаторної коробки (верхня частина), діаметр якої дещо менший, ніж внутрішній діаметр корпусу колони. Отже, між каталізаторною коробкою і корпусом утворюється щілина. Холодна суміш азоту з воднем надходить у колону через цю щілину і запобігає перегріванню корпусу. Газова суміш іде донизу, проходить між гарячими трубками теплообмінника, нагрівається і потрапляє до каталізаторної коробки. Тут, на каталізаторі, відбувається синтез аміаку. Синтез аміаку - реакція екзотермічна, і теплота газів, що виходять з колони синтезу, в теплообміннику (мал. 15) використовується на підігрівання азотноводневої суміші до 400—500 °С. Так здійснюється принцип теплообміну, теплота реакції утилізується - це один з важливих принципів сучасного виробництва.
Газ, що виходить з колоші синтезу, містить 12-15 % аміаку. В такому разі не зрозуміло, чому синтез вважається економічно доцільним. Річ у тім, що далі в процесі виробництва використовують принцип циркуляції - технологічний процес, в якому речовини, що не прореагували, відділяються від продуктів реакції і знову повертаються в реакційний апарат. За цим принципом азот і кисень, що не прореагували, відокремлюються від зрідженого аміаку і знову повертаються в колону синтезу. Завдяки принципу циркуляції на сучасних заводах вихід аміаку становить 96–98 %.
В 1913 р. в Німеччині було збудовано завод синтезу аміаку. В Україні перший завод з виробництва синтетичного аміаку став до ладу у 1933 р. в Горлівці Донецької області. Пізніше з'явилися заводи у Дніпродзержинську (1938), Сіверськодонецьку (1958), Черкасах (1962), Рівному (1965) тощо. Нині триває робота з дальшого вдосконалення технології аміачного виробництва.
3. ПИТАННЯ ЕКОЛОГІЧНОЇ ЧИСТОТИ ВИРОБНИЦТВА.
У гру вводиться фахівець-еколог (захист біосфери від викидів хімічних виробництв, створення безвідхідних виробництв).
Над проблемою повної утилізації та переробки відходів виробництва аміаку нині працюють інженери і техніки. Адже реалізація принципу безвідхідності дає змогу не тільки істотно збільшувати вихід кислоти, підвищувати ефективність виробництва, а й охороняти здоров'я людей і зберігати чистоту навколишнього середовища. Звертається увага учнів на те, що використання у виробництві циклічних процесів, зменшення викидів в атмосферу реагентів, продуктів реакції, тепла веде до зменшення забруднення навколишнього середовища і наближає підприємство до екологічно чистого виробництва..
VI. Закріплення знань учнів.
Завдання.
1) Назвіть умови, необхідні для скраплення аміаку.
2) Якою є роль каталізатора? (Відповідь повинна базуватися на понятті«енергія активації».)
3) Після пропущення 10 л (н. у.) суміші азоту і водню через апарат для синтезу аміаку її об'єм зменшився в 1,172 рази. Обчисліть масу амоній сульфату, яку можна синтезувати з аміаку.
VI. Завдання додому.
Вивчити § 7. Виконати завдання 46*,47*.
VII. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.