ТЕМА УРОКУ: "Нітрати й ортофосфати. Нітратні й ортофосфатні добрива. Запобігання негативному впливу нітратів на організм людини. Раціональне використання добрив та проблема охорони природи"
МЕТА УРОКУ: Закріпити знання учнів про загальні властивості солей, способи їх одержання на прикладі нітратів і фосфатів. Обговорити проблеми забруднення харчових продуктів хімічними речовинами на прикладі нітратів. Ознайомити із загальними властивостями мінеральних добрив та їх класифікацією. Стисло охарактеризувати найважливіші нітратні й фосфатні добрива, показати їх значення в народному господарстві. Визначити роль Нітрогену й Фосфору в живих організмах. Розглянути кругообіг Нітрогену в природі
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
Ми вже вивчили з вами елементи головної підгрупи п'ятої групи. Два з цих елементів, зокрема Нітроген та Фосфор, є «елементами життя». Вони входять до складу тканин живих організмів, і тому повинні складати основу живлення тварин і рослин.
ІІІ. Повідомлення теми, мети уроку.
Сьогодні на уроці мова піде про властивості, значення та використання макро- та мікродобрив та їх вплив на організм і оточуюче середовище. Епіграф:
„Земля – не вічна благодать. Коли далекого нащадка
ти пустиш в світ з котомкою, їй буде нічого подати.”
IV. Актуалізація знань.
Диктант.
1. Напишіть формули: аміаку, нітратної кислоти, нітроген (IV) оксиду, калій нітрату, амоній хлориду, амоній нітрату, амоній фосфату, нітроген (II) оксиду.
2. Виберіть нітрати, назвіть їх: HCl, HNO3, Mg(NO3)2, NaNO3, NaCl, NH4NO3.
Відповіді біля дошки.
1. Одержіть трьома способами нітрат кальцію.
2. Де більше міститься N (нітрогену) – у NaNO3 чи Mg (NO3)2?
3. Запишіть формули Нітроген (ІІ) і Нітроген (ІV) оксиду. Вкажіть їх фізичні властивості. Доведіть за допомогою рівнянь реакцій, що один із них солетворний, а інший ні.
4. Запишіть формули Нітратної кислоти. Вкажіть її фізичні властивості. Доведіть за допомогою рівнянь реакцій, що вона може проявляти властивості, схожі до інших кислот, а також специфічні.
V. Вивчення нового матеріалу.
1. СОЛІ НІТРАТНОЇ КИСЛОТИ – НІТРАТИ
Одноосновна нітратна кислота утворює середні солі – нітрати. Нітрати натрію, калію, амонію і кальцію називають селітрами. Всі нітрати добре розчиняються у воді.
Завдання.
Складіть рівняння реакцій, в результаті яких утворюються нітрати: взаємодія нітратної кислоти з основами; з основними оксидами; з металами, аміаком; реакція обміну між солями.
2. ХІМІЧНІ ВЛАСТИВОСТІ НІТРАТІВ, ЯКІСНА РЕАКЦІЯ НА НІТРАТ – ІОНИ.
Завдання.
Запишіть реакції, що характеризують хімічні властивості нітратів, а також є спільними з іншими солями.
Робота з підручником.
Специфічною властивістю нітратів є їх розклад при нагріванні. Схема термічного розкладу нітратів розглядається по підручнику.
Демонстрація. «Розклад натрій нітрату при нагріванні»
Кристалічну калійну селітру нагрівають у пробірці до розплавлення, продовжуючи ще деякий час. При термічному розкладі селітри виділяється кисень, який легко виявити, якщо в пробірку внести тліючу скіпку: вона яскраво спалахне.
Якісна реакція на нітрат-іон.
Якісною реакцією на нітрат-іон NO3- є нагрівання розчину досліджуваної солі з концентрованою сульфатною кислотою і міддю. Сульфатна кислота витісняє нітратну з її солі, а та реагує з міддю, в результаті можна спостерігати виділення бурого газу.
3. МІНЕРАЛЬНІ ДОБРИВА.
Мінеральні добрива люди стали застосовувати ще в давнину. Так, на початку нашої ери римлянам було відомо, що не тільки перегній, але й деякі мінеральні речовини, наприклад, попіл, гіпс, вапно та інші сприяють підвищенню росту рослин. У ті часи ще ніхто не міг пояснити, чому на схилах Везувію врожаї значно вищі, ніж на схилах гір невулканічного походження. Для пояснення дії добрив наводились такі припущення: «Землю треба досита нагодувати, і вона відновить свої сили». Тільки в XVI столітті з'являються праці, які більш-менш вірно пояснюють значення добрив. А чи зможе сьогодні нагодувати нас з вами виснажена земля? Однозначна відповідь – ні! Мінеральні добрива, які використовуються у сільському господарстві, можна класифікувати так: прості (азотні, фосфорні, калійні), комплексні (складні, змішані).
Азотні добрива, їх вплив на ріст і розвиток рослин
Нітроген - невід'ємна складова частина рослинних і тваринних організмів. Найбільше його міститься в атмосфері де він займає 79% об'єму. У ґрунтах його всього 0,03%, а це дуже мало для рослин і організмів (атмосферний азот вони не засвоюють). Нітроген входить до складу багатьох органічних сполук: білків, нуклеїнових кислот, алкалоїдів, антибіотиків. Без білків немає життя, а без Нітрогену немає білків, тому зрозумілою стає його роль у живій природі. Зв'язаний Нітроген може в незначних кількостях потрапити у ґрунт завдяки грозовим дощам і бобовим рослинам. Нітроген — це елемент, без якого неможливе нормальне існування рослин на Землі. Але його кількість має бути в межах тієї норми, яка потрібна рослині. Так, наприклад:
• Якщо рослина містить недостатню кількість Нітрогену, то, по-перше, затримується її ріст і розвиток. По-друге, гальмується ріст і формування листків: вони стають дрібними, мають світло-зелений колір і передчасно жовтіють внаслідок зменшення вмісту хлорофілу. Крім того, якщо не вистачає Нітрогену, стебла рослин стають тонкими і слабо розгалужуються, погіршується також ріст і формування репродуктивних органів та наливання зерна.
• Надлишок Нітрогену призводить до надмірного розвитку вегетативної маси, знижує стійкість рослин до несприятливих метеорологічних умов, грибних і бактеріальних хвороб. У цьому випадку подовжується період розвитку і достигання, зменшується частка репродуктивних органів у загальній масі рослини, а також може погіршуватись якість отриманої продукції.
 • У ґрунти Нітроген в сполуках з різними елементами потрапляє завдяки дощам, в яких розчинено солі
• У ґрунти Нітроген в сполуках з різними елементами потрапляє завдяки дощам, в яких розчинено солі
амонію, нітрати та аміак. Для збільшення вмісту Нітрогену у ґрунті застосовують азотні добрива. Це здебільшого солі або інші речовини, що містять Нітроген. До них належать селітри - нітрати лужних і лужноземельних металів та амонію, а також інші солі амонію, рідкий аміак та аміачна вода. Між іншим, деякі такі солі відіграють подвійну роль. Наприклад, Са(СN)2 виробники бавовни використовують і для підживлення ґрунтів Нітрогеном, і як дефоліант (речовина, яка викликає відпадання листків перед збором бавовни).
• Природні запаси одного з найкращих добрив натрієвої селітри містяться у пустелі Атакама і Чилі, то му її називають чилійською. Та людство вже давно навчилось синтезувати азотні добрива в необхідній кількості. Тому частка природної селітри в світовому виробництві цього продукту не перевищує 1,5 %.
Фосфорні добрива
Фосфор необхідний рослинам. Внесення фосфатних добрив збільшує врожай. Фосфорне живлення підвищує стійкість рослин до несприятливих умов і прискорює їхнє дозрівання. Фосфор утворює в рослині енергетично збагачені хімічні зв'язки. Фосфор (разом з Нітрогеном) є основою для нуклеїнових кислот, за допомогою яких передаються спадкові ознаки наступним поколінням.
Фосфор прискорює розвиток рослин збільшує врожайність. Фосфор широко розповсюдженні у природі. Фосфатні добрива виготовляють з фосфоритів і апатитів. Рослини дістають Фосфор із ґрунту у вигляді йонів солей фосфатної кислоти. Після відмирання тварин і рослин їх залишки потрапляють у ґрунт. Так відбувається кругообіг Фосфору в природі. Основні фосфорні добрива - суперфосфат (простий і подвійний) і фосфорне борошно. У нейтральних ґрунтах Фосфор суперфосфату перетворюється на кальцій гідроген фосфат. Подвійний суперфосфат - концентроване фосфорне добриво, яке від простого відрізняється тим, що має значно менший вміст кальцій сульфату. Преципітати - концентроване фосфорне добриво (порошок білого або кремового кольору), застосовується як добриво і кормова мінеральна добавка до кормів у тваринництві і як добриво, придатне до використання на всіх ґрунтах.
Добрива і навколишнє середовище
Внесення у ґрунт органічних і мінеральних добрив є одним із важливих агрономічних заходів. Завдяки добривам врожаї збільшуються на 50 %. Обсяг
щорічного використання мінеральних добрив у світі перевищує 140 млн. т. Але внесення добрив у ґрунт може як приносити користь, так і завдавати шкоди. Надлишкове внесення у ґрунт добрив призводить до збільшення кількості пестицидів у вирощуваній продукції, а це шкідливо для тварин, що споживають ці рослини, а також і для нас з вами. Надлишок добрив також шкодить безпосередньо ґрунтам, санітарному стану навколишнього середовища, водоймам і річкам. Нестача добрив теж негативно впливає на ріст рослин. І лише їх раціональне використання дає бажаний результат і не шкодить навколишньому середовищу. Охороні навколишнього середовища і ґрунтів сприяє впровадження сучасних прогресивних систем підживлення згідно з якими необхідно дотримуватись встановлених норм внесення добрив: на легких ґрунтах застосовувати гранульовані добрива; не вносити добрив у талий ґрунт; азотні добрива вносити навесні; не вносити добрива у ґрунт водоохоронних зон; узгоджувати підживлення з прогресивними агрохімічними заходами, сівозмінами і раціональними способами захисту рослин.
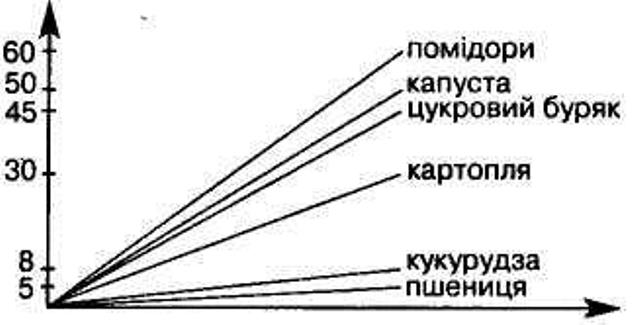
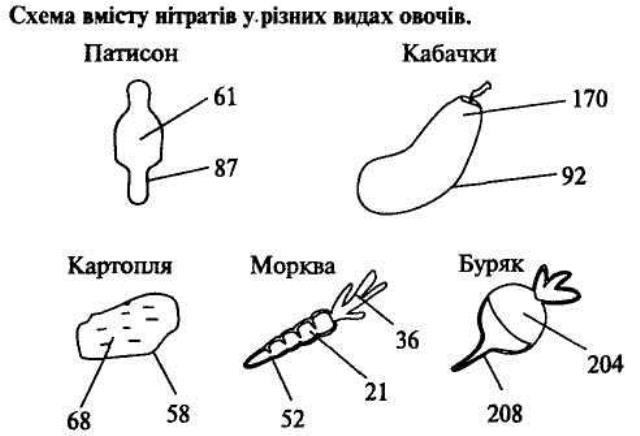
4. ВМІСТ НІТРАТІВ В ОВОЧАХ ТА ФРУКТАХ.
У зв'язку з хімізацією сільського господарства після застосування мінеральних добрив на полях з метою підвищення врожаю вирощуваних культур виникла проблема нітратів, їх шкідливого впливу на організм людини.
В місцевостях, де використовують добрива, вміст нітратів збільшився в рослинах, ґрунтових водах, атмосфері. Кількість нітратів, що накопичується в сільськогосподарських культурах, можна визначити за видом рослин, генетичними факторами, умовами навколишнього середовища, а також за допомогою способу ведення сільського господарства. Деякі культури здатні накопичувати високий вміст нітратів. У продуктах харчування нітрати можуть накопичуватись в концентраціях, небезпечних для здоров'я людини. Для кожної культури існують практично допустимі норми нітратів, які не завдають шкоди здоров'ю людини.
В овочевих культурах найбільше нітратів накопичується в зелені (петрушка, кріп, салат), коренеплодах (редька, редиска, червоний буряк). Порівняно мало їх накопичується в томатах та картоплі. Ранні овочі накопичують нітратів більше, ніж пізні. Оскільки у теплицях підвищена вологість і наявний дефіцит світла, концентрація нітратів в овочах, вирощених в теплиці, більша, ніж в овочах, вирощених на відкритому ґрунті. Найбільший вміст нітратів наявний у рослинах в період цвітіння.
Забруднення нітратами питної води, харчових продуктів може призвести до негативних змін у стані здоров'я населення.
Нітрати потрапляють з водою та їжею до шлунку і, відновлюючись до нітритів, всмоктуються в кров.
Клінічні симптоми отруєння - гіпоксія, прискорена робота серця, болів області печінки.
Щорічний аналіз, який проводять органи охорони здоров'я, свідчить, що за останні роки простежується тенденція до зростання кількості серцево-судинних захворювань та злоякісних новоутворень. Одною з причин цих захворювань є вплив нітратів.
Припустима кількість нітратів у овочах
|
Овочі |
Нітрати, мг/кг |
Овочі |
Нітрати, мг/кг |
|
Картопля |
80 |
Огірки |
150 |
|
Капуста |
300 |
Кавун |
45 |
|
Морква |
300 |
Диня |
45 |
|
Цибуля |
60 |
Томат |
60 |
|
Буряк |
140 |
Цибуля «перо» |
400 |
Пам'ятайте! Миття й очищення овочів знижують уміст нітратів приблизно на 10 %. Під час відварювання овочів у відвар переходить до 50 % нітратів. Під час консервування та квашення до 30 % нітратів переходить у розчин.
VI. Закріплення знань учнів.
Завдання.
1. Напишіть рівняння розкладання натрій нітрату, нікелю, срібла, міді.
2. Дано розчини трьох кислот: хлоридної, сульфатної і нітратної. Як їх розпізнати?
3. Чи будуть накопичуватися нітрати в рослинах, якщо їх багато в ґрунті? Наскільки це небезпечно? Запропонуйте способи зменшення нітратів у продуктах.
4. При повному розкладі нітрату одновалентного металу маса твердого продукту склала 63,5 % від вихідної маси нітрату. Установіть формулу нітрату.
5. Гази, одержані при термічному розкладі 27,25 г суміші натрій нітрату і купрум (II) нітрату, пропустили через 115, 2 мл води. При цьому 1,12 л газу не поглинулися. Визначте масові частки речовин у вихідній суміші й масову частку речовини в розчині, одержаному після поглинання газів.
6. Назвіть формулу ортофосфатної кислоти. Вкажіть її фізичні властивості.
7. Перелічіть хімічні властивості ортофосфатної кислоти. Запишіть якісну реакцію на фосфат-іон.
8. Здійснити такі перетворення: Н3РО4 ↔NаН2РО4↔Nа2НРО4 ↔Nа3РО4.
9. Дано розчини чотирьох кислот: хлоридної, сульфатної, нітратної і фосфатної. Як їх розпізнати?
10. Чому слід вносити мінеральні добрива в ґрунт?
VIІ. Завдання додому.
Вивчити § 16 – 17, виконати завдання: ст. 75, № 101 – 104.
VIIІ. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.
МІНЕРАЛЬНІ ДОБРИВА
Будівельним матеріалом для будь-якого живого організму, у тому числі й рослини, служать певні поживні речовини. Три елементи життя — Нітроген, Фосфор і Калій — потрібні рослинам понад усе, і саме їх найменше залишається в ґрунті після збирання врожаю. Щорічно з урожаєм з кожного гектару поля виноситься в середньому біля 22,2 кг азоту, 8,7 кг фосфору (V) оксиду і 25,8 кг калій оксиду.
Необхідно вносити ці речовини штучно. Здавна було помічено, и< врожайність підвищують гній, пташиний послід, торф, відходи боєві і пивоварень. Ці так звані органічні добрива використовують і сьогодні Але, на жаль, не можна цілком компенсувати втрати життєво важливих елементів із ґрунту внесенням лише органічних добрив. Тому добувають Нітроген, Фосфор і Калій з корисних копалин і вносять їх у землю в най більше «легкотравному» для рослин вигляді, наприклад у вигляді роз чинних мінеральних солей.
Нітроген у вигляді селітри почали вносити в ґрунт тоді, коли сам Нітроген ще навіть не був відкритий. А наприкінці XIX ст. було вже ясно, ще вносити в землю треба і Нітроген, і Фосфор, і Калій. Добривами були прості природні сполуки, неочищені і піддані єдиній обробці – розмолу, наприклад: чилійська селітра МагГО3, фосфоритне борошно Са3 (РО4)2, або сильвініт (КС1 • КаСІ). До складу будь-якій руди, крім сполук, корисних для рослин, входять шкідливі речовини: флуору фосфоритному борошні, хлор у сильвініті. Основну масу такого добрива складали елементи баластні, які при внесенні добрив просто засмічували поля, а на перевезення цього баласту потрібні були додаткові витрати.
На початку XX ст. виробництво добрив у світі починає досить швидко зростати. Одночасно починає змінюватися і їхній склад. Спочатку ця зміна пішла через підвищення масової частки діючої речовини. Якщо у кальцієвій селітрі тільки 14—15,6 % Нітрогену, то у аміачній селітрі — 35 %, а у сечовині — 45—46 %. У простому суперфосфаті — 14—21 % Р2О6, а у подвійному — 44—48 %. Що стосується калій хлориду, то вміст в ньому калію в перерахунку на К2О складає — 60—62 %.
Потім почали виготовляти складні добрива — спершу це були механічні суміші простих добрив, а потім стали одержувати хімічні сполуки, до складу яких входять декілька основних елементів. Так, у калієвій селітрі це Калій і Нітроген, в амофосі — Нітроген, і Фосфор, а в нітрофосці — Нітроген, Фосфор і Калій.
Крім Нітрогену, Фосфору і Калію, рослинам необхідні й інші елементи. Ті самі мінеральні добрива засвоюються значно краще, якщо в ґрунті в достатній кількості присутні Бор, Купрум, Цинк, Магній, Кобальт, Молібден, Марган і багато інших елементів. Ці речовини вносять в ґрунт в невеликих кількостях (2—20 кг/га) і тому їх називають мікроелементами. Якщо їх не вистачає, рослини починають хворіти: у них порушується процес фотосинтезу, дихання, утворення білків, вітамінів, вуглеводів.
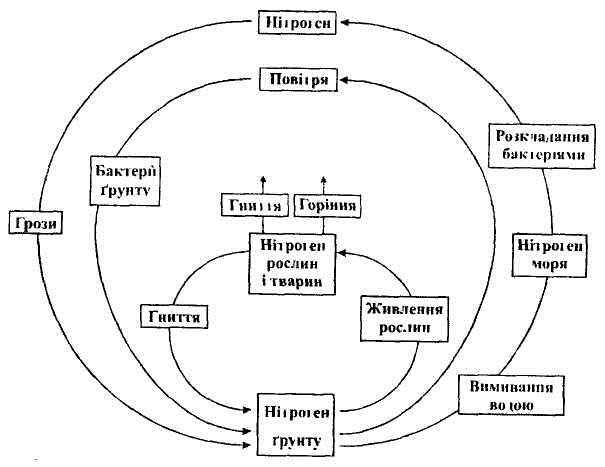 5. КРУГООБІГ НІТРОГЕНУ В ПРИРОДІ.
5. КРУГООБІГ НІТРОГЕНУ В ПРИРОДІ.
Внаслідок гниття і горіння органічних речовин частина зв'язаного Нітрогену звільняється і надходить в атмосферу. Однак у природних умовах вміст зв'язаного Нітрогену в ґрунті не зменшується. А маса вільного азоту в атмосфері не збільшується. Чим це можна пояснити?
Рослини засвоюють Нітроген неорганічних сполук, які є у ґрунті у вигляді йонів NH4+ і NO3- Тварини, у свою чергу, поїдають рослини. У процесі гниття рослин і тварин під впливом спеціальних бактерій органічні сполуки Нітрогену перетворюються на неорганічні і знову повертаються у ґрунт. Ці сполуки знову засвоюються рослинами, а цикл перетворень залишається: 3NO2 + Н2O = 2НNО3 + NO.
Під час грозових розрядів невелика кількість Нітрогену зв'язується і утворюється нітроген (ІІ) оксид, а з нього внаслідок окиснення киснем – нітроген (ІV) оксид . При реакції з водою з нітроген(ІV) оксиду утворюється нітратна кислота, яка перетворюється в ґрунті на нітрати.
Зв'язування атмосферного азоту (перетворення на органічні речовини) в біосфері здійснюється за рахунок бульбочкових бактерій, що містяться на корінні деяких бобових рослин (конюшина, люцерна, лютик). Існують і зворотні процеси: за допомогою спеціальних бактерій відбувається розкладання нітрогеновмісних речовин і виділення вільного азоту в атмосферу. При збиранні врожаю з полів виноситься значна частина Нітрогену. Ці витрати поповнюють внесенням азотовмісних добрив.
Робота з підручником. Кругообіг Нітрогену учні розглядають самостійно.