ТЕМА УРОКУ: "Лужні елементи. Натрій і Калій. Оксиди, гідроксиди, солі Натрію і Калію.
Застосування найважливіших сполук Натрію та Калію. Калійні добрива"
МЕТА УРОКУ: Поглибити й розширити знання про метали на прикладі лужних металів Натрію і Калію. Вивчити зв’язок між властивостями оксидів, гідроксидів, солей Натрію та Калію/їхнім одержанням і застосуванням. Розвивати на-вички складання рівнянь хімічних реакцій на прикладі хімічних властивостей Натрію, Калію та їхніх сполук
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
ІІІ. Повідомлення теми, мети уроку.
Тема записується на дошці, мета повідомляється усно.
IV. Актуалізація знань.
Завдання:
1. Зобразити електронну будову: а) атома та іона Натрію; б) атома й іона Калію.
2. Виходячи з будови електронної оболонки атомів та іонів Натрію і Калію, пояснити їхні хімічні властивості.
3. Напишіть формули сполук: натрій оксиду, натрій пероксиду, цезій гідроксиду, літій фосфату, калій гідрофосфату, поташу (калій карбонату), соди (натрій карбонату), питної соди (натрій гідрокарбонату).
4. Записати рівняння реакцій взаємодії натрію і калію з галогенами (хлором чи іодом) і Сульфуром. Назвати речовини, що утворюються.
5.Записати рівняння реакцій згорянні лужних металів на повітрі та утворення пероксидів.
6. Написати рівняння реакції взаємодії натрію з водою. Назвати продукти реакції.
V. Повторення вивченого матеріалу.
1. ТЕОРЕТИЧНИЙ МАТЕРІАЛ.
До І групи елементів належать лужні метали: Літій, Натрій, Калій, Рубідій, Цезій і Францій. Свою назву вони отримали від назви своїх гідроксидів, які через хорошу розчинність здавна називалися лугами.
Лужні метали є найактивними з усіх металів. Вони дуже добрі відновники, активно сполучаються з киснем, взаємодіють з усіма іншими неметалами, а також зі складними речовинами, такими як вода, оксиди металів, солі. У цьому випадку вони відновлюють інші метали до вільного стану.
Найбільш активним металом є Францій, який зустрічається в продуктах радіоактивного розпаду актинію і сам є радіоактивним. Висока хімічна активність лужних металів пояснюється малим значенням енергії, необхідної для відриву єдиного електрона від атома. Так, цезій втрачає електрон при освітленні, тому він застосовується для фотоелементів.
Літій був відкритий у 1817 р. і нині застосовується для виготовлення різних сплавів, збільшення їх твердості, як окисник під час одержання міді. Натрій та калій — найбільш поширені й широко застосовувані представники лужних металів. Вони були відкриті і вперше виділені у вільному стані у 1807 р. англійським хіміком Г.Деві.
Натрій входить до складу багатьох мінералів. Найважливішою є сполука Натрію з Хлором (кам'яна, або кухонна, сіль). Також поширені натрій сульфат (глауберова сіль), натрій карбонат (сода), натрій нітрат (селітра). Товщина шару натрій хлориду в деяких родовищах досягає кількох сотень метрів.
Калій входить до складу майже всіх рослин (найбільше його в картоплі, абрикосах). Інші лужні метали знаходяться у вигляді домішок у мінералах Натрію і Калію.
Сплави натрію і калію є теплоносіями в ядерних реакторах. Натрій як більш дешевий метал використовують частіше, ніж калій. Натрій широко застосовують в органічному синтезі для одержання металоорганічних сполук, а також у металургійній промисловості.
Лужні метали - сріблясті речовини, з характерним блиском на свіжозрізаній поверхні. Усі вони дуже легкі й легкоплавкі. Зберігають ці метали у гасі, а літій (найлегший метал) -у вазеліні.
2. РОЗВЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ ЗА ДОПОМОГОЮ РІВНЯНЬ ХІМІЧНИХ РЕАКЦІЙ
1). Для заливання лужних акумуляторів використовують розчин калій гідроксиду з масовою часткою КОН 30 %. Обчисліть масу калій гідроксиду, необхідного для приготування 10 кг такого розчину.
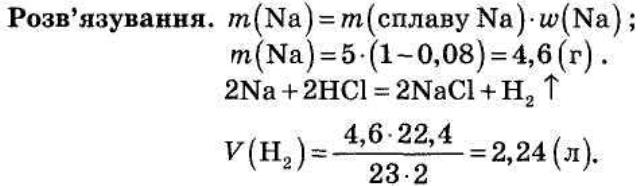
Розв'язування. m(КОН) = 10 · 0,3 = 3 (кг).
2). Який обсяг водню (н. у.) можна добути при дії хлоридної кислоти на 5 г сплаву натрію, що містить 0,08 масових частин домішок?
VI. Закріплення знань учнів.
ПЕРША ГРУПА. Сценка №1 - „Лужні метали і галогени”.
ДІЙОВІ ОСОБИ. Натрій, Літій, Калій, Цезій.
(На дошці – плакат: „Зал засідань”. Стіл, стільці. Виходять метали під парасольками, Цезій – у темних окулярах.)
НАТРІЙ (встає) Я – спікер Верховної Ради першої групи. Шановні депутати, головна підгрупа! Засідання прошу вважати відкритим. На порядку денному одне питання – вода! Ми. лужні метали, вимагаємо: „Геть воду! Світ без вода!”. Не потрібні нам річки, озера, дощ, сніг, моря та океани! Висловлюйтеся з даного питання. Вносьте свої пропозиції.
(Лунають вигуки: „Ні воді!”, „Нехай буде сонце!”, „Воду геть”)
НАТРІЙ. Увімкніть другий мікрофон.
ЛІТІЙ. Я маю пропозицію: або всі повинні плавати у гасі, або кожного, як і мене , треба посадити у вазелін. Я чемпіон серед металів: 5 разів поборов Алюміній, 15 – Залізо, 40 – Осмій, Ми зважувалися!!! Так що мені все життя сидіти у вазеліні бо я найлегший метал?! Неподобство!! А окисники: – Галогени і кисень! Геть гангстерів Галогенів та кілера Кисня! Нехай буде сухо! Нехай буде сонце!
НАТРІЙ. Увімкніть перший мікрофон.
КАЛІЙ Вельмишановні панове! Ми маємо достатньо ворогів: і воду, і мафіозні структури Галогенів, і Кілера Кисня. З цим я згодний. Але ж не треба забувати, що ми найм’якіші за характером. Нас можна різати найтупішим ножем, тому прошу внести мою пропозицію до заключного документа: вивести з обігу всі гострі предмети. Ганьба ножам!
НАТРІЙ. Увімкніть другий мікрофон.
ЦЕЗІЙ. Колеги – депутати! Я виступаю від фракції "Францезій". Ми підтримуємо вищезгадані пропозиції. Але ж, шановні! Яке сонце?! У нас, Франція та Цезія, по одній клепці – електрону – в голові Як і у вас у всіх (до лужних металів). Під дією сонця їх вибиває. Ви не можете погодитися на порушення майнового цензу ваших колег – депутатів Вимоги щодо сонця – зняти!
НАТРІЙ. Враховуючи пропозиції депутатів, прийнято таке рішення: 1). одну парасольку на всіх; 2). світ без води; 3). без окисників та ножів; 4). живемо без сонця.
Хто за прийняття даної постанови? Одноголосно! Вважаю засідання закритим.
(Метали встають і співають)
Ми бідненькі метали,
Ніхто нас не пасе.
В нас крадуть електрони.
Хто ж нас спасе?
Рятуйте нещасні метали!
(Входять Галогени.)
Ми - Галогени-розбійнички,
Розбійнички, розбійнички!
Віддай електрон -
І ви іончики, іончики, іончики!
(Забирають кульки від металів, закривають парасольки і виходять, тягнучи метали за собою.)
ДРУГА ГРУПА. Казка.
Дуже давно в Хімляндії жив Король. Звати його було Натрій. Одружився він з красунею Водою і з'явився в них синок. Натрій Гідроксид. Жвавий такий, жартівник. Як бризне своєю бризкав-кою на мундир герцога Фенолфталеїну, так той і стане малиновим, бризне на оранжеву сукню Метилоранжу той пожовтіє, а фіолетовий костюм Лакмусу враз синіє. Іноді спересердя придворні називали його «їдким натрі». Але була в нього і хороша риса — він дуже любив чистоту і навіть сам навчився мило робити. Жили вони, поживали і горя не знали, та ось напали на країну злі Хлоридна і Сульфатна Кислоти. Пішов на війну Натрій Гідроксид і його лицарі Метали та Оксиди МgO і Аl2О3. Тільки п’ять металів не воювали. Довго боролися з Кислотами і побороли їх, але й самі постраждали. Пішла королева Вода шукати своїх рідних, а на полі - біло-біло, не видно нікого, тільки сіль навкруги. Заплакала королева, річкою стала, а потім морем. З того часу вода в морі - солона.
ТРЕТЯ ГРУПА.
1. Чи відбуваються зміни з іонами натрію: а) при взаємодії їдкого натру із хлоридною кислотою; б) при взаємодії їдкого натру з розчином купрум хлориду; в) при прожарюванні натрій гідрокарбонату; г) при електролізі розплавленого їдкого натру?
ЧЕТВЕРТА ГРУПА.
2. Сріблясто-біла легка проста речовина «А», що має гарну тепло й електропровідність, реагує з водою при нагріванні, при цьому утворюються дві речовини - проста й складна «В». Речовина«В» реагує з кислотою «С», утворюючи сіль, розчин якої при додаванні барій хлориду дає білий осад, нерозчинний у кислотах і лугах. Назвіть передбачувані речовини «А», «В» і «С».Відповідь: А - Ме, В - МеОН, С - Н2SО4, де Ме - будь-який лужний метал.
П’ЯТА ГРУПА.
3. Натрій пероксид, реагуючи з вуглекислим газом, утворює натрій карбонат і вільний кисень. Написати рівняння реакції. Для чого ця реакція застосовується на підводних човнах? Який обсяг вуглекислого газу може поглинути 78 кг натрій пероксиду, і який обсяг кисню при цьому утвориться (н. у.)? (Пероксиди - це хімічні сполуки, що містять безпосередньо зв'язані один з одним атоми Оксигену. Їх розглядають як солі гідроген пероксиду Н2О2 (Н-О-О-Н). Зв'язок -О-О- не міцний і зумовлює нестійкість молекули. Гідроген пероксид є сильним окисником (підпалює папір, тирсу й інші горючі матеріали). Натрій пероксид знайшов застосування як джерело кисню в протигазах і на підводних човнах 2Nа2О2 +2СО2 = 2Nа2СО3 +O2.)
VIІ. Завдання додому.
Повторити вивчений матеріал по конспекту.
Виконати завдання.
1. Складіть хімічні рівняння таких перетворень: Натрій → Натрій гідроксид → Натрій хлорид → Натрій. Які з цих реакцій належать до окисно-відновних? Складіть електронний баланс.
2. Як здійснити такі перетворення:
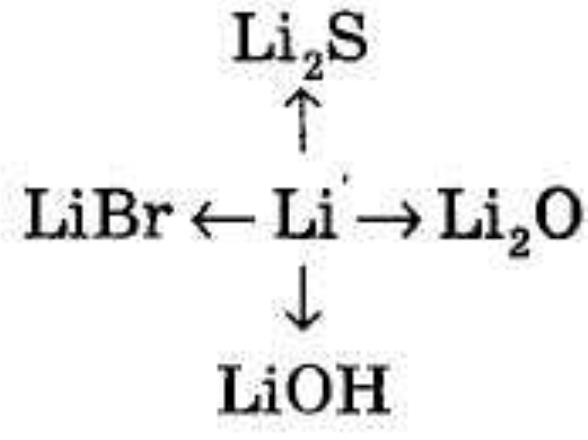
VIIІ. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.