ТЕМА УРОКУ: "Кислоти, їхній склад, назви, класифікація. Оксигеновмісні та безоксигенові кислоти"
МЕТА УРОКУ: Ознайомити учнів зі складом, формулами, назвами, класифікацією кислот. Розглянути фізичні властивості кислот, їх поширення у природі; розвивати пізнавальний інтерес до вивчення теми.
ХІД УРОКУ
І Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ Мотивація уроку.
У нашому житті ми постійно зустрічаємося з кислотами. Яблуко кисле, бо в ньому є яблучна кислота, «вкусила» кропива, бо в ній є мурашина кислота, дома печеться пиріг - не обійтись без оцтової кислоти, а як виїхати з дому на машині, якщо немає акумулятора (сульфатна кислота входить до складу електроліту). Тому темою сьогоднішнього уроку будуть кислоти.
ІІІ Повідомлення теми, мети уроку.
IV Актуалізація знань.
Бесіда.
1. Що таке оксиди, які бувають оксиди?
2. Що утворюють оксиди з водою?
Завдання:
1). Вкажіть формули кислотних та основних оксидів і назвіть їх:
SО3, Аg2O, Al2O3,. N2O5, Р2О5, СаО, SО2, FеО, МgO.
2) Допишіть рівняння хімічних реакцій:


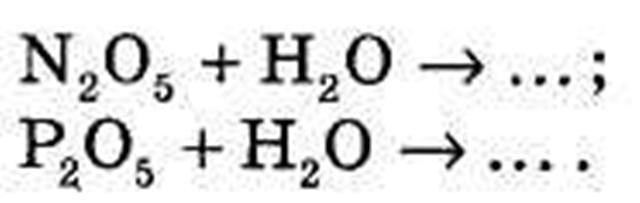
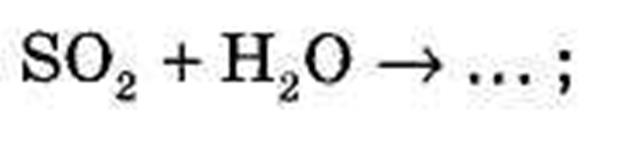
V Вивчення нового матеріалу.
1. СКЛАД І НАЗВИ КИСЛОТ.

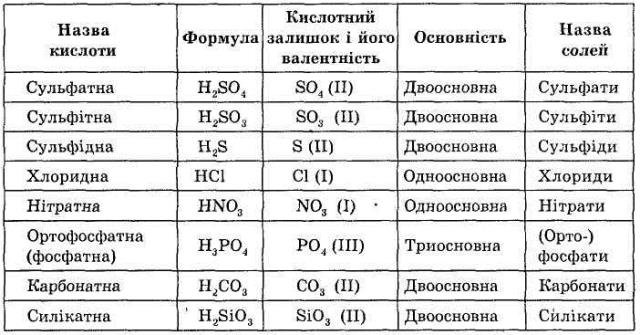
У всіх кислот є загальні властивості, які дозволяють об'єднати їх в один клас: це наявність рухливого атома Гідрогену, що визначає властивості кислот і додає їм кислого смаку (звідси й назва класу). Символ елемента Гідрогену стоїть на першому місці у формулах кислот.
Кислоти - складні речовини, до складу яких входять атоми Гідрогену й кислотного залишку.
Робота по заповненню таблиці «Формули й назви кислот».
У формулах кислот можна виділити кислотний залишок, до його складу може входити атом чи група атомів. Валентність кислотного залишку й основність кислот визначається за числом атомів Гідрогену.
2. КЛАСИФІКАЦІЯ КИСЛОТ.
1) Класифікація за атомами Оксигену: 2) Класифікація за атомами Гідрогену:


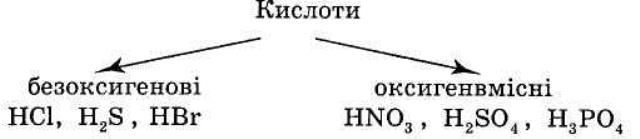
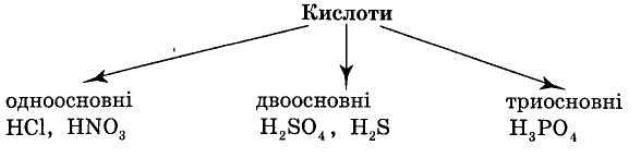
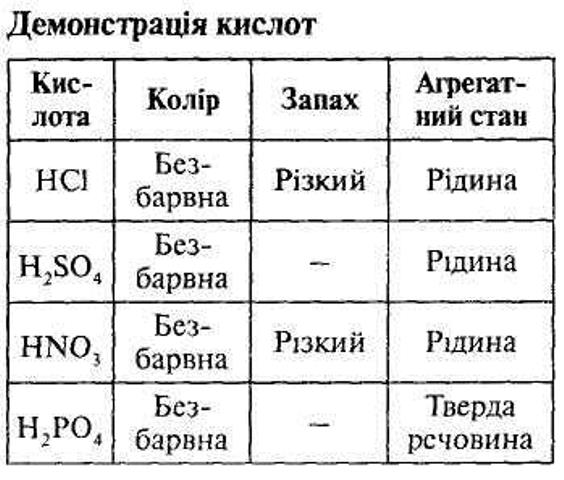 3.
3.  ФІЗИЧНІ ВЛАСТИВОСТІ КИСЛОТ.
ФІЗИЧНІ ВЛАСТИВОСТІ КИСЛОТ.
Гази - Н2S, НСl (переважно безоксигенові); рідини - НNО3, Н2SО4;
тверді - Н3РО4, НРО3, Н2SіO3, добре розчинні у воді, виняток - Н2SіO3.
Майже всі кислоти безбарвні; за смаком переважно кислі, солодкі й деякі зовсім без смаку, мають запах.
Дослід 1.Скляною паличкою наносять краплі концентрованої Н2SО4 на тканину, білий папір.
Дослід 2.У стакан з концентрованою Н2SО4 опускають дерев'яну скіпку.
Висновок: кислоти небезпечні - вони роз'їдають папір, деревину, тканини.
4. ПОШИРЕННЯ КИСЛОТ У ПРИРОДІ.
Кислоти широко поширені в природі. Приклади органічних кислот: оцтова, яблучна, щавлева, лимонна, молочна кислота, що містяться у відповідних продуктах; мурашина кислота міститься у виділеннях мурах, у пекучих волосках кропиви, входить до складу отрути жалючих комах; з уроків анатомії відомо, що хлоридна кислота входить до складу шлункового соку; під час грози утворюється нітратна кислота, що поповнює запаси азоту в ґрунті.
Робота з підручником. Ознайомлення з поширенням кислот в природі
5. ПРАВИЛА РОБОТИ З КИСЛОТАМИ.
Під час розведення кислот необхідно приливати кислоту у воду невеликими порціями помішуючи, але не навпаки. Під час розведення кислот виділяється велика кількість теплоти. Вода більш теплоємна, ніж кислота, тому якщо потроху вливати кислоту у воду, то вся теплота, що виділяється, устигає поглинутися водою, якщо ж робити навпаки, то теплота, що виділяється, не встигає поглинутися кислотою, а йде на розігрів води, що додається. Вода скипає й вихлюпується назовні разом із крапельками кислоти. Це може привести до серйозного опіку.
Спочатку - вода, потім - кислота,
Бо трапитись може велика біда.
Демонстрація.
1) Розведення сульфатної кислоти водою.
У склянку наливають воду. Вимірюють температуру. Потім порціями доливають сульфатну кислоту, помішуючи скляною паличкою. Ще раз вимірюють температуру.
2) Руйнування паперу сульфатною кислотою.
Розчином сульфатної кислоти за допомогою скляної палички пишуть чи малюють на папері. Лист обережно провівають над нагрівальним обладнанням. Поступово папір руйнується та напис чи малюнок стають видними.
Акцентується увагу учнів на правилах техніки безпеки під час чоботи з кислотами:
у разі потрапляння кислоти на шкіру негайно змити її проточною водою до зникнення відчуття печії, потім і промити розчином питної соди й звернутися до медпункту; під час потрапляння кислоти в очі треба промити їх водою та негайно звернутися до лікаря; працювати з кислотами необхідно в халаті.
Нас, кислот, запам'ятай:«аш» спочатку - так і знай,
і як впізнаєш, що це ми, руки й одяг бережи!
VI Закріплення знань учнів.
Бесіда
1. Які речовини називаються кислотами?
2. Назвіть оксигеновмісні кислоти; безоксигенові кислоти.
3. Назвіть одно-, дво- і триосновні кислоти.
4. Під час взаємодії яких речовин одержують розчинні кислоти?
5. Опишіть фізичні властивості кислот.
3) Де в природі зустрічаються кислоти?
Хімічний диктант (одна формула - 1 бал).
Карбонатна кислота - Н2СО3;
Хлоридна кислота – НСl;
Сульфатна кислота - Н2SО4;
Нітратна кислота - НNO3;
Сульфідна кислота - Н2S;
Метафосфатна кислота - НРО3;
Силікатна кислота – Н2SіО3;
Фторидна кислота - НF;
Іодидна кислота – НI;
Ортофосфорна кислота - Н3РО4.
Сульфітна кислота - Н2SО3;
Бромідна кислота – НBr;
Гра «Третій зайвий» (викресліть зайву кислоту).
а)НС1, НВг, Н2S (основність - Н2S);
б)Н2SО3, Н2S, НNO3 (оксигеновмісні - Н2S);
в)НРО3, Н3РО4, НNO3 (якісний склад - HNО3);
г) НNO3, Н2SО4, Н2СО3 (основність - НNОз); д) НСl; Н2SО4, Н2СО3 (слабка - Н2СО3).
VIII Завдання додому.
Вивчити: § 27, з.1 с. 112. Принести лимон, кисле молоко, яблуко, сік, оцет.
Завдання Обчисліть масові частки елементів у: сульфатній і нітратній кислоті.
VII Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.
ДОДАТКОВИЙ МАТЕРІАЛ ДО УРОКУ №41
Хлоридна (соляна) кислота (на дошці картка з формулою НС1) входить до складу шлункового соку (майже 0,3 %) і сприяє перетравленню їжі, а також вбиває хвороботворні бактерії. Важко сказати, хто й коли вперше одержав хлоридну кислоту. Відомо, що ще наприкінці XV — на початку XVI ст. цю речовину назвали «кислим спиртом», або «соляним спиртом».
Сульфатна (сірчана) кислота (на дошці картка з формулою Н2SО4). Алхіміки називали її «купоросною олією». її одержують уже понад 1000 років. Без її допомоги не можна отримати врожаю, бо на виробництво мінеральних добрив витрачається майже половина всієї сульфатної кислоти, яку отримують на хімічних заводах. Сьогодні без сульфатної кислоти неможливо ні взутися, ні вдягнутися, ні вмитися, ні випрати білизну, тому що і взуття, і одяг, і мило, і порошок теж виготовляють за допомогою сульфатної кислоти. А яка машина чи мотоцикл зможе проїхати без акумулятора, що не містить електроліту (розчину сульфатної кислоти)? Взагалі, легше було б навести ті галузі промисловості (хоча це дуже важко), де вона не застосовується.
Нітратна (азотна) кислота (на дошці картка з формулою НNО3). Алхіміки назвали цю речовину «міцною водою» і використовували для виготовлення «царської горілки» (суміш нітратної і хлоридної кислот, яка розчиняла «царські метали» - золото і срібло). Нітратна кислота використовується для виробництва різних речовин, в тому числі мінеральних добрив (нітратів), які рослини поглинають з ґрунту, утворюючи білок - основу всього живого. Використовують її також для виробництва барвників, вибухових речовин, ліків (стрептоцид), кіно– та фотоплівки.
Ортофосфатна (фосфатна) кислота (на дошці картка з формулою Н3РО4) міститься в нашому організмі та входить до складу речовин, які відіграють головну роль у передачі та збереженні спадкової інформації. Щоденно із сечею з організму дорослої людини виводиться близько 4 г фосфатної кислоти. Ця речовина використовується для виробництва мінеральних добрив - фосфатів, а також кормових добавок, для надання кислуватого смаку безалкогольним напоям, з метою освітлення цукру.
Карбонатна (вугільна) кислота (картка з формулою Н2СО3) – речовина дуже нестійка. Міститься в мінеральній воді, лимонаді, саме завдяки їй ці напої мають кислий та освіжаючий смак. Велике значення мають солі цієї кислоти, що використовуються як будівельні матеріали.
Силікатна (кремнієва) кислота (на дошці картка з формулою Н2SіО3) – одна з мінеральних кислот, що не розчиняється у воді. Велике значення мають її солі, особливо в техніці, за допомогою яких виготовляють скло, фаянс, цемент, бетон, цеглу та різні керамічні вироби.
А чи знаєте ви, що: деякі голо зяброві морські молюски, захищаючись, виділяють зі своїх залоз сульфатну кислоту, яка впливає на шкіру та органи нападника.
Уривок з оповідання М. М. Пришвіна «Соляна кислота»:
«Известно ли вам, что в кормлении волчат участвует и самец-волк? У матери в молоке не хватает необходимой для питания молодых волков соляной кислоты, и, чтобы пополнить этот недостаток, в добавку к молоку надо отрыгнуть маленькому своей пищи с соляной кислотой. В таком кормлении принимает участие и волк-самец».
|
Н2SО4 В этом городе кислоты Заняты своей работой. Пусть своими голосами О себе расскажут сами.
HNO3 Средь кислот одна из главных, Людям я служу исправно. Если где-то там стреляют, Поджигают и взрывают, Это все свершила я - Кислота азотная. Но не только для солдат Очень так стараюсь я. Вы спросите у крестьян, Пусть они признаются: Чтобы вырос урожай Помидоров в поле, Обойтись никак нельзя Без нитратной соли.
Н3РО4 Фосфорная кислота В обращении проста. Служит людям много лет, С ней достигнешь ты побед. Чтоб растенья крепче были, Не болели и не гнили, Их бы нужно подкормить, Удобренья применить. И если рост дает азот, То фосфор силу им дает А двойной суперфосфат Вдвое больший даст заряд.
|
НСІ Чтоб охотней покупали, Чтобы был опрятный вид, Все изделия из стали Лучше никелем покрыть. Удалим оксидов слой Ми соляной кислотой, А потом в особой ванне Гальванируем металлы. Или если раковина Ржавчиной покрыта, Не поможет даже« Мистер Мускул » знаменитый. Лишь соляная кислота Помогает нам всегда. H2CO3 Очень вкусная всегда Минеральная вода. Но без углекислоты Не получишь ее ты. Н2SО4 Известная в целом мире. Ее хоть и не знают, Но все же применяют. Она очистит газы И их осушит сразу, Краситель образует И взрыв организует, Основа для лекарства И сельского хозяйства, Получит удобренья И сахар для варенья. Она - в аккумуляторе, В химическом реакторе И в производстве каждый час Всегда важна, как кровь, для нас.
|