ТЕМА УРОКУ: "Реакції обміну між розчинами електролітів. Іонні рівняння"
МЕТА УРОКУ: Розкрити суть реакцій йонного обміну, з'ясувати умови їх перебігу; навчити учнів складати повні та скорочені рівняння реакцій йонного обміну та пояснювати їх суть з позицій теорії електролітичної дисоціації, прогнозувати хід реакцій та підбирати вихідні речовини за скороченими йонними рівняннями реакцій обміну; вдосконалити вміння проводити хімічні досліди й робити узагальнюючий висновок про умови, за яких реакції йонного обміну відбуваються до кінця.
ХІД УРОКУ
І. Організація класу.
Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів.
ІІ. Мотивація уроку.
Ми будемо учасниками однієї казки – «Про жорстокого царя Обміна». В ній ви зустрінетеся з царем, його прекрасною донькою, канцлером Тлумачником, лицарями та принцами. Ви будете підданими. Тож розпочинаймо.
ІІІ. Повідомлення теми, мети уроку.
Сьогодні ви починаєте знайомство з реакціями обміну між розчинами електролітів. На уроці ви:
а) дізнаєтесь, у чому полягає суть реакцій та йонного обміну;
б) з'ясуєте умови перебігу реакцій обміну;
в) навчитеся складати рівняння реакцій в молекулярній, повній та скороченій йонних формах;
г) складатимете молекулярні рівняння за скороченими йонними рівняннями.
IV. Актуалізація знань.
У великому та красивому царстві Розчин володарював жорстокий цар Обмін. І була в того царя гарна донька Реакція, яку він ховав від усіх в лабіринті розчинності, але чутки про її красу дійшли до найвіддаленіших куточків царства. Тяжко жилося підданим в Обміна, бо частина природних процесів зникла. Почули про це принци сусідніх земель і почали до палацу з'їжджатися, щоб визволити доньку царя та завоювати її серце. Та підступний цар наказав вигадати для них випробування. Аж ось і принци.
Цар. Знаю, знаю, чому ви тут! Але я свою доньку не можу віддати за всіх одразу, тому вирішив я влаштувати між вами змагання. Хто дійде до кінця живим, тому й дістанеться принцеса.
1-й принц. Ми згодні, оголошуй свої змагання!
2-й принц. Ми всі безстрашні і легко виконаємо всі завдання!
Цар. Канцлере, оголошуй!
Канцлер. Увага. увага! За наказом його величності царя Обміну оголошується змагання, яке складається з трьох випробувань. Перше та друге випробування виконують ваші піддані, бо саме вони працюватимуть на Реакцію тому мусять бути сильними.
1 випробування.
Дайте відповідь на такі питання:
- Що таке електроліти? Наведіть приклади.
- Що таке неелектроліти? Наведіть приклади.
- Які електроліти називають сильними? Від чого залежить сила електроліту?
- Які електроліти називають слабкими?
- Що таке електролітична дисоціація? Як вона відбувається?
- Дайте визначення кислоти, основи, солі з точки зору електролітичної дисоціації.
Цар. З першим завданням ви впоралися.
Канцлер. Друге випробування носить практичний характер. Напишіть рівняння дисоціації таких сполук: Н2СО3, Fе(ОН)3, СаSО4, FеСl2, NH4NО3.
Цар. Щось ти, канцлере, легкі випробування вигадав.
Канцлер. Не хвилюйтеся, ваша величносте! В мене третє завдання дуже важке.
Цар. Що, знову для підданих?
Канцлер. Ні, вже для принців, бо з ними будуть битися три наших лицарі. Познайомтеся, перший лицар, володар нітратної кислоти; другий лицар, володар барій хлориду; третій лицар, володар калій карбонату. Всі вони відважні й дуже хитрі.
V. Вивчення нового матеріалу.
Цар. Ну що ж, чи не поясниш, Тлумачнику, як мої підлеглі здолають принців?
Канцлер. Вони їх можуть розчинити під час реакції, бо в розчинах електроліти розщеплюються на йони і між ними йдуть війни, які називають йонними реакціями. В багатьох випадках вони нескінченні.
Цар. Добре, розпочинай!
Канцлер. Який сміливець спробує першим?
I принц. Я, принц Натрій Фосфатович.
Канцлер. Розпочинаємо перший бій.
Ведучий. Зіткнувшись в поєдинку з першим лицарем, не витримав натиску нітратної кислоти Натрій Фосфатович та й покинув вести війну з нею.
Цар. Канцлере, як це трапилося, поясни мені.
Канцлер. Я вам покажу графічно:
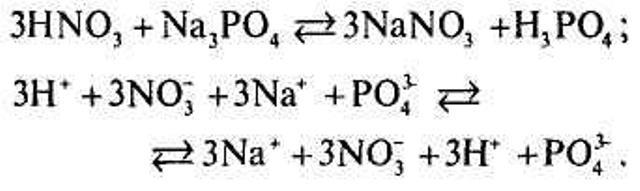
Йони не зв'язуються, тому війна йде з рівними силами.
Цар. Це мені подобається, продовжуй.
Канцлер. Оголошується другий бій, між Магній Сульфатовичем та другим лицарем його величності.
Ведучий. Зіткнувся Магній Сульфатович з барій хлоридом, та його теж спіткала невдача.
Після цих поєдинків інші претенденти відмовилися від битви Зрадів цар Обмін, що ніхто не виграв доньчиної руки, день проходить — все спокійно, другий проходить — нікого. Цар вже й заспокоївся. Аж на третій день з'явився сміливий принц Умовник з царства Випадковості.
Умовниік. Я хочу звільнити Реакцію!
Цар. А хіба ти не чув, що треба пройти тобі нелегкі випробування?
Умовник. Я готовий через них пройти, але я не привів своїх підданих.
Канцлер. Не хвилюйтеся, їх величність великодушно дозволяє вам розпочати третє випробування, але вам доведеться подолати аж трьох лицарів. Бій призначається на завтра.
Ведучий. Цієї ночі не спалося принцові, він мріяв про доньку царя. Та не знав Умовник, як завтра переможе лицарів з їх чарами. Раптом з неба впала зірка, і він загадав бажання.
Умовник. Хай мені завтра допоможуть небесні сили!
Ведучий. І перед ним з'явилася фея Хімія.
Хімія Тільки я можу тобі допомогти. Візьми в оцій склянці розчин їдкого натру (бач, який він сердитий), використай його в боротьбі з чарами першого лицаря. В другу я тобі налила натрій сульфату — він допоможе тобі приборкати чари другого лицаря. А щоб перемогти третього лицаря, тобі потрібна хлоридна кислота. Не переплутай склянки, бо тоді станеться лихо. Прощавай, хай тобі щастить!
Ведучий. І фея Хімія зникла...
Настав ранок. Фанфари сповістили про початок турніру.
Виконується лабораторна робота 4.
Умовник. Жителі царства Розчин, я хочу, щоб ви допомогли мені звільнити Реакцію з лабіринту розчинності й повернути все на свої місця.
Канцлер. Перший поєдинок!
Ведучий. Умовник протиставив підступній нітратній кислоті розчин їдкого натру, який загинув, але знищив також і кислоту.
Канцлер. Другий поєдинок!
Виконується лабораторна робота 2.
Ведучий. На полі битви зійшлися барій хлорид та натрій сульфат. Дві ріки їх розчинів зіткнулися та утворили поклади білої солі. Бачить цар, що непросто буде перемогти Умовника, та він покладав надії на третього лицаря.
Канцлер. Третій поєдинок!
Виконується лабораторна робота 3.
Ведучий. Став атакувати Умовника калій карбонат, та наткнувся на хлоридну кислоту. Зашипів калій карбонат, залишилося від нього тільки мокре місце та газ.
Цар. Ти переміг моїх лицарів і здобув прекрасну Реакцію. Перемігши лицарів, сміливцю, ти звільнив доньку з лабіринту розчинності. Віддаю тобі її руку.
Ведучий. З цього часу зажили в мирі та злагоді всі піддані царства Розчин. А цареві не давало спокою питання про те, як принц досяг перемоги.
Цар. Тлумачнику, поясни, чому принц зміг перемогти наших лицарів?
Канцлер. Він, ваша величносте, виявився хитрішим за нас. Умовник використав такі речовини, які зв'язували йони наших чар. Ось погляньте сюди. У першому випадку утворилась малодисоційована речовина Н2О. Я вам зараз все покажу.
Алгоритм запису іонних рівнянь.
- Записуємо реакцію в молекулярному вигляді: НNО3 + NaОН → NaNО3 + Н2О.
- Урівнюємо рівняння, якщо це необхідно.
- Записуємо, які речовини дисоціюють у воді, тобто повне йонне рівняння реакції. Вода майже не дисоціює, тому її залишаємо в молекулярному вигляді: Н+ + NO3-+ Na++ОН- → Na+ +NO3- +Н2О.
- Як бачимо, до реакції та після неї в розчині знаходяться однакові йони, скоротимо їх та отримаємо скорочене йонне рівняння реакції: Н++ОН- → Н2О.
А тепер свої знання спробують продемонструвати ваші піддані.
Два учні на дошці за допомогою Канцлера записують інші рівняння.
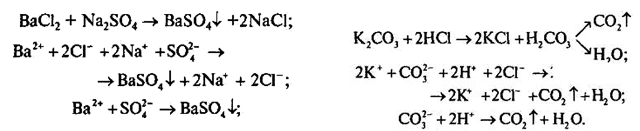
Канцлер. Реакції з утворенням осаду, виділенням газу або утворенням малодисоційованої речовини незворотні, тому Умовник переміг.
Ведучий. Тут і казці кінець, а хто слухав – молодець!
VI. Закріплення знань учнів. Зараз ми дізнаємося, хто був уважний і добре слухав казку.
- Що таке йонні реакції?
- Коли йонні реакції йдуть до кінця?
- Наведіть алгоритм написання рівнянь, реакцій йонного обміну.
Для реакцій, що відбуваються до кінця, напишіть молекулярне, повне та скорочене йонні рівняння: (самостійна робота із взаємоперевіркою).
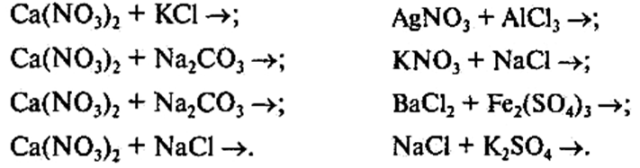
VIІ. Завдання додому.
Вивчити параграф, підготуватися до практичної роботи №2.
VIIІ. Підсумок уроку.
Підсумовується робота учнів на уроці, визначаються змістовні і слабкі відповіді, виставляються оцінки за урок.