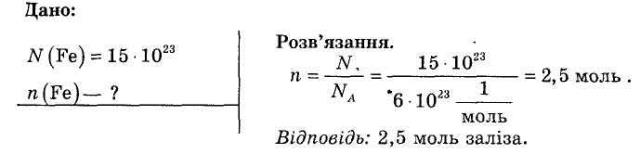Сайт учителя хімії Видай Олени Василівни
|
Статистика
Онлайн всього: 1 Гостей: 1 Користувачів: 0 |
Кількість речовини. Моль – одиниця кількості речовин. Стала Авогадро
ТЕМА УРОКУ: "Кількість речовини. Моль – одиниця кількості речовин. Стала Авогадро"
МЕТА УРОКУ: Сформувати поняття про кількість речовини; з’ясувати значення сталої Авогадро; випрацювати вміння розрахувати число атомів і молекул за відомою кількістю речовини й кількість речовини – за відомим числом атомів чи молекул. ХІД УРОКУ I. Організаційний етап Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів. II. Мотивація навчання Для вивчення навколишнього світу потрібно не лише спостерігати й описувати об’єкти, а треба їх характеризувати якимись величинами. Сьогодні на уроці ми вивчимо нову величину, за допомогою якої розв’язуються задачі за рівняннями хімічних реакцій. III. Актуалізація опорних знань В основі багатьох задач з хімії лежать рівняння хімічних реакцій. Подивимось, чи не забули ви як записуються ці рівняння і як розставляються коефіцієнти. Бесіда з елементами самостійної роботи по питанням попередньої теми: 1.Сформулювати закон, завдяки якому записуються рівняння хімічних реакцій і пояснити, що при цьому відбувається з атомами та молекулами. 2.Що називають рівняннями хімічних реакцій? Показати це на прикладі. 3.Розставити коефіцієнти в рівняннях реакцій: а) Zn + O2 = ZnO; б) Al + S = Al2S3; в) КClO3 = КСl + O2. 4. Скласти рівняння хімічних реакцій за такими схемами: а) Mg + O2 =; Al + Cl =; Na + S =; б) P + O2 =; H2 + Cl2 =; Al + O2=. IV. Вивчення нового матеріалу.
Проблема: Необхідно одержати сульфід феруму за реакцією: Fe + S = FeS Запитання. Яку кількість речовини сірки і заліза необхідно взяти? З формули видно, що на один атом заліза потрібно один атом сірки. Значить треба таку кількість цих речовин, щоб в них було однакове число атомів. А як виміряти таку кількість? Будь-яка фізична величина – це певна характеристика об'єктів або явищ, яка може бути виміряна. Наприклад, властивості інертності тіла відповідає величина, яку називають масою, властивості просторової протяжності відповідає величина, яку називають довжиною. У хімії, крім використання таких величин, як «маса» й «об'єм», застосовують величину «кількість речовини». Кількість речовини – це фізична величина, обумовлена числом структурних елементів: атомів, молекул, або груп атомів, які містяться в даній порції речовини. Кількість речовини позначається літерою ν, читається „ню” . 2. МОЛЬ – ОДИНИЦЯ ВИМІРЮВАННЯ КІЛЬКОСТІ РЕЧОВИНИ. Запитання. Як ви гадаєте, в чому можна вимірювати кількість речовини? Кількість структурних елементів можна вимірювати в штуках. Тільки атоми чи молекули дуже незручно вимірювати в штуках, тому що побачити або вибрати одну молекулу надзвичайно важко. Навіть якщо використовувати кратні величини – кілоштуки (103) або гігаштуки (109), то й такі кількості дуже важко відміряти. Тому хіміки ввели дуже велику порцію для вимірювання кількості речовини – 6,02 1023 штук. На честь відомого італійського вченого хіміка XIX століття Амедео Авогадро (1776-1856), який математично розрахував це число, називається «числом Авогадро». Одиниця вимірювання кількості речовини – моль. 1 моль – це така кількість речовини, яка містить стільки частинок цієї речовини (молекул, атомів), скільки міститься атомів в 12 г Карбону, тобто 6,02 1023. Розрахуємо це число атомів Карбону: N = 0,012кг / 1,993 10-26кг = 6,02 1023. Це означає, що1 моль Н2О, 1 моль О2, 1 моль СО2 містить одне й те саме число частинок, що і 1 моль С, тобто 6, 02 1023. Також використовуються кратні величини, як кіломоль (кмоль, 103 моль), мілімоль (ммоль, 10-3 моль), мікромоль (мкмоль, 10-6 моль). Число Авогадро - це дуже велике число. Наприклад, якби всю поверхню Землі (включаючи річки, озера, моря й океани) вистелити рівномірним шаром такої кількості однодоларових купюр, то утворився б шар висотою 2 метри. Така кількість тенісних м’ячиків вкрила б земну поверхню шаром товщиною 100 км. Проте молекули, які ми рахуємо за допомогою сталої Авогадро, є дуже маленькими часточками. Якщо ми візьмемо 6,02 1023 молекул води, то навіть не зможемо наповнити склянку, це тільки невеличкий ковток води. Які маленькі ці молекули! Фізико-хімічну константу, яка відповідає цьому числу називають „сталою Авогадро” і позначають Na, якщо 1 моль речовини містить це число часток, то стала Авогадро дорівнює: Na = 6,02 1023 / 1 моль = 6, 02 1023 моль-1 Стала Авогадро показує число частинок (атомів, молекул або груп атомів), які містяться в 1 моль речовини незалежно від її агрегатного стану. Запитання. Як ви гадаєте, якщо ми візьмемо один моль двох різних речовин, чи будуть це однакові кількості за зовнішнім виглядом? (Ні. Об'єм або маса, який буде займати 1 моль речовини, буде залежати від об'єму або маси, який займає молекула цієї речовини. Оскільки в різних речовин різні молекули, то й об'єм, і маса 1 моль речовин будуть різні.) Демонстрація різних речовин кількістю в 1 моль. Увага звертається на те, що маса й об’єм 1 моль різних речовин відрізняються. Запитання. Який висновок про співвідношення розмірів і мас молекул або атомів води, заліза, кухонної солі, цукру й газу можна зробити? Повернемось до одержання сульфіду феруму з сірки із заліза. На 1 моль FeS потрібно взяти 1 моль Fe і 1 моль S,а це значить, що в реакцію повинні вступити 6,02 1023 молекул сірки і така ж кількість атомів заліза. Як практично виміряти дану кількість ми дізнаємось на наступному уроці. 3. РОЗРАХУНОК КІЛЬКОСТІ РЕЧОВИНИ ЗА ВІДОМИМ ЧИСЛОМ АТОМІВ І МОЛЕКУЛ. Для розрахунку кількості речовини використовується формула: ν=N / Na , де N — кількість часточок ( атомів або молекул), Na – число Авогадро. Розв'язування задач. Яка кількість речовини містить 15 1023 атомів заліза?
Завдання: 1.Скільки молекул містить водень кількістю речовини 1 моль, 2 моль? (усно) 2.Скільки молекул міститься в H2SO4 кількістю речовини 2 моль? (самостійно) 3.Дано: а) 3 103 атомів Сульфуру; б) 12 1023 атомів Сульфуру. Обчисліть кількість речовини (два учні біля дошки). Робота в групах (оформлені роботи на аркушах від кожної групи здають учителю).
Вивчити: § 1, виконати завдання 3 (усно), а 4-5 (письмово) після параграфа.
Підсумовується робота на уроці: відзначаються активні і пасивних і учні, вказуються на змістовні і слабкі відповіді, виставляються окремим учням оцінки за урок, а основна маса отримає оцінки після перевірки завдань, що виконувались в групах.
ДОДАТОК ДО УРОКУ Завдання для шести груп 1.Скільки атомів міститься в міді кількістю речовини: 1 моль,0,5 моль, 0,02моль? 2.Скільки атомів міститься в білому фосфорі (Р4), кількістю речовини: 3,5моль, 0,25моль, 0,05моль? 3.Яка кількість речовини атомів Карбону міститься в 1 моль: а) СН4; б) С2Н6; в) С4Н10 ? 4. Яка кількість речовини атомів Оксигену міститься в 1 моль речовин: а) калій (І) оксид; б) сульфур (IV) оксид; в) сульфур (VI) оксид. 5. Яка кількість речовини атомів Оксигену міститься в 1 моль речовин: а) манган (VII) оксид; б) бор (III) оксид; в) хлор (V)оксид. 6. Яка кількість речовини атомів Гідрогену міститься у воді кількістю речовини: а) 0,01 моль; б) 0,5 моль; в) 2 моль. |
Пошук
Календар
Архів записів
|
||||||||||||||||||||||||||||||||||||||||||||